
铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第ⅠB族。Cu2+的核外电子排布式为________________________。
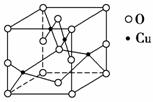
(2)如图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为________。
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下:
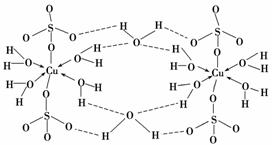
下列说法正确的是________(填字母)。
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。
(5)Cu2O的熔点比Cu2S的________(填“高”或“低”),请解释原因_______________________________________________________________________。
解析 (1)电子排布为结构化学中的重点。特别是24号、29号,存在半充满和全充满状态的元素。Cu2+应先写出Cu原子的电子排布,然后从外向内失去2个电子。
(2)对O2-个数的计算,面上的按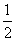 算,顶点上按
算,顶点上按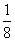 算,棱上按
算,棱上按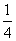 算,体心按1个算,可得O2-个数为:
算,体心按1个算,可得O2-个数为: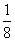 ×8+
×8+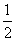 ×2+
×2+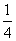 ×4+1=4(个)。
×4+1=4(个)。
(3)H2O中氧原子采用sp3杂化,SO 中的氧不是。CuSO4应是离子晶体,不是分子晶体。
中的氧不是。CuSO4应是离子晶体,不是分子晶体。
(4)电负性:F>N>H,所以NH3中的N原子提供孤对电子共用,Cu2+提供空轨道,形成配位键,而NF3中N原子受F原子的影响,不易提供孤对电子。
(5)离子晶体中,离子键越短,离子键越强,离子化合物熔点越高,由于O2-的半径小于S2-的半径,所以Cu+与O2-形成的离子键强于Cu+与S2-形成的离子键。
答案 (1)1s22s22p63s23p63d9或[Ar]3d9 (2)4 (3)BD (4)F的电负性比N大,N—F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子 (5)高 Cu2O与Cu2S相比,阳离子相同、阴离子所带电荷也相同,但O2-的半径比S2-小,所以Cu2O的晶格能更大,熔点更高


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
甲~辛等元素在周期表中的相对位置如下表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素。下列判断正确的是( )
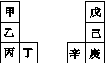
A.金属性:甲>乙>丁
B.原子半径:辛>己>戊
C.丙与庚的原子核外电子数相差13
D.乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应:2NO2 2NO+O2 在密闭容器中反应,达到平衡状态的标志是:( )
2NO+O2 在密闭容器中反应,达到平衡状态的标志是:( )
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2 的同时,生成2n mol NO
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
⑥ 混合气体的平均相对分子质量不再改变的状态
A. ①④⑥ B.②③⑤ C.①③④ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。请回答下列问题:
(1)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+49.0kJ/mol
②CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H=-192.9kJ/mol
由上述方程式可知,CH3OH(g)的燃烧热____(填“大于”、“等于”或小于”)192.9kJ/mol。已知水的气化热为44 kJ/mol,则表示氢气燃烧热的热化学方程式为______________________________。
(2)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考查温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃)
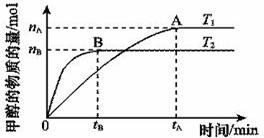
该反应为_________反应(填“放热”或“吸热”);在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氮氧化铝(AlON)属原子晶体,是一种超强透明材料,下列描述错误的是
A.AlON和石英的化学键类型相同
B.AlON和石英晶体类型相同
C.AlON和Al2O3的化学键类型不同
D.AlON和Al2O3晶体类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)
ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g)
ΔH2=-1 160 kJ·mol-1
若在标准状况下用CH4还原4.48 L NO2气体至N2,则下列说法中正确的是
A.该过程吸收的热量为86.7 kJ
B.此过程中需要CH4气体1.12 L
C.转移的电子数为0.8NA个
D.已知2NO(g)+O2(g)===2NO2(g) ΔH=-114 kJ·mol-1,则CH4的燃烧热是802 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应A(g)+3B(g)  2C(g) ΔH=-Q kJ·mol-1。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 mol A和3 mol B,在一定条件下达到平衡时放出热量为Q1 kJ;在相同的条件下,向乙容器中加入2 mol C达到平衡后吸收热量为Q2 kJ;已知Q1=3Q2。下列叙述不正确的是
2C(g) ΔH=-Q kJ·mol-1。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 mol A和3 mol B,在一定条件下达到平衡时放出热量为Q1 kJ;在相同的条件下,向乙容器中加入2 mol C达到平衡后吸收热量为Q2 kJ;已知Q1=3Q2。下列叙述不正确的是
A.甲中A的转化率为75%
B.Q1+Q2=Q
C.达到平衡后,再向乙中加入0.25 mol A、0.75 mol B、1.5 mol C,平衡向正向移动
D.乙中的热化学方程式为2C(g)  A(g)+3B(g) ΔH=+Q2 kJ·mol-1
A(g)+3B(g) ΔH=+Q2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列选项中最后的物质是要制取的物质,其中不可能得到的是( )
A.CaCO3 CaO
CaO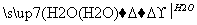 Ca(OH)2
Ca(OH)2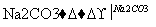 NaOH溶液
NaOH溶液
B.Cu CuO
CuO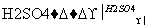 CuSO4溶液
CuSO4溶液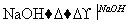 Cu(OH)2沉淀
Cu(OH)2沉淀
C.KMnO4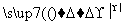 O2
O2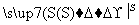 SO3
SO3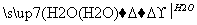 H2SO4溶液
H2SO4溶液
D.BaCO3 BaCl2溶液
BaCl2溶液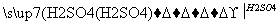 BaSO4沉淀
BaSO4沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
D
解析:A项,CaCO3与CO2、H2O反应生成的Ca(HCO3)2与NaHCO3不反应.B项,向Na2CO3溶液中滴加等物质的量的HCl时,发生反应:CO +H+===HCO
+H+===HCO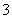 ,不生成CO2.C项,等质量的NaHCO3和Na2CO3分别与足量盐酸反应时,NaHCO3产生的CO2多.D项,向饱和Na2CO3溶液中通入CO2时发生反应:Na2CO3+CO2+H2O===2NaHCO3↓,反应中消耗H2O,且生成的NaHCO3溶解度小、质量多,故NaHCO3会结晶析出.
,不生成CO2.C项,等质量的NaHCO3和Na2CO3分别与足量盐酸反应时,NaHCO3产生的CO2多.D项,向饱和Na2CO3溶液中通入CO2时发生反应:Na2CO3+CO2+H2O===2NaHCO3↓,反应中消耗H2O,且生成的NaHCO3溶解度小、质量多,故NaHCO3会结晶析出.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com