
氮氧化铝(AlON)属原子晶体,是一种超强透明材料,下列描述错误的是
A.AlON和石英的化学键类型相同
B.AlON和石英晶体类型相同
C.AlON和Al2O3的化学键类型不同
D.AlON和Al2O3晶体类型相同
科目:高中化学 来源: 题型:
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为________,氧化性最弱的简单阳离子是________。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是__________________________________;
制铝时,电解Al2O3而不电解AlCl3的原因是______________________________。
(4)晶体硅(熔点1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)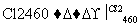 SiCl4
SiCl4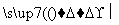 SiCl4(纯)
SiCl4(纯) Si(纯)
Si(纯)
写出SiCl4的电子式:________________;在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:________________________________________________________________________
________________________________________________________________________。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是________。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知0.1 mol•L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
A. 加少量烧碱溶液 B. 加醋酸钠 C. 加少量冰醋酸 D. 加水
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组比值为1∶2的是( )
A.0.1 mol/L与0.2 mol/L醋酸溶液,c(H+)之比
B.0.1 mol/L H2S溶液,c(S2-)与c(H+)之比
C.pH=10的Ba(OH)2溶液与pH=10的氨水,溶质的物质的量浓度之比
D.pH=3的硫酸与pH=3的醋酸溶液,c(SO42-)与c(CH3COO-)之比
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC2的晶体为离子晶体,其阳离子与阴离子的个数比为1∶1,D的二价阳离子比C的简单阴离子多一个电子层。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E原子序数为26。回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)。
(1)E在周期表中的位置__________________________________________(指明周期和族)。
(2)A、B、C的第一电离能由小到大的顺序为__________________________________。
(3)B的氢化物的分子空间构型是________;AC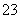 的中心原子采取________杂化。
的中心原子采取________杂化。
(4)写出任意一种由两种元素组成的与DC2中的阴离子互为等电子体的微粒的化学式________________________________________________________________________。
(5)E的高价态离子和低价态离子均能与A、B两元素按原子个数比1∶1形成的带一个单位负电荷的阴离子组成六配位的配离子。写出该配离子的化学式________________________(任写一种)。
(6)X是周期表中电负性最大的元素,该元素与D元素组成的离子化合物的晶胞如下图所示。该离子化合物的化学式为________。
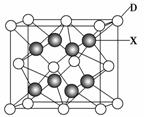
查看答案和解析>>
科目:高中化学 来源: 题型:
铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第ⅠB族。Cu2+的核外电子排布式为________________________。
(2)如图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为________。
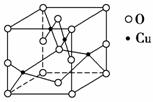
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下:
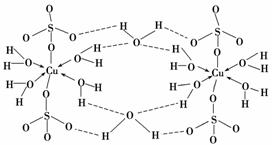
下列说法正确的是________(填字母)。
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。
(5)Cu2O的熔点比Cu2S的________(填“高”或“低”),请解释原因_______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2Zn(s)+O2(g)===2ZnO(s)
ΔH=-701.0 kJ·mol-1
2Hg(l)+O2(g)===2HgO(s) ΔH=-181.6 kJ·mol-1
则反应Zn(s)+HgO(s)===ZnO(s)+Hg(l)的ΔH为
A.+519.4 kJ·mol-1 B.+259.7 kJ·mol-1
C.-259.7 kJ·mol-1 D.-519.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
常用作风信子等香精的定香剂D以及可用作安全玻璃夹层的高分子化合物PVB的合成路线如下:

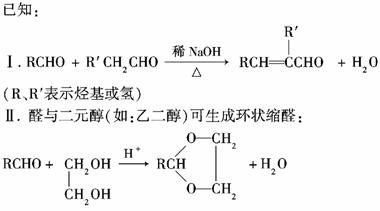
(1)A的核磁共振氢谱有两种峰,A的名称是________。
(2)A与  合成B的化学方程式是__________________________。
合成B的化学方程式是__________________________。
(3)C为反式结构,由B 还原得到。C的结构简式是
______________________________________________________________________ __。
__。
(4)E能使Br2的CCl4溶液褪色。N由A经反应①~③合成。
a.①的化学试剂和条件是___________________________________ ___。
___。
b.②的反应类型是_____________________________________________。
c.③的化学方程式是__________________________________________________。
(5)PVAc由一种单体经加聚反应得到,该单体的结构简式是____________________。
(6)碱性条件下,PVAc完全水解的化学方程式是__________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com