
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC2的晶体为离子晶体,其阳离子与阴离子的个数比为1∶1,D的二价阳离子比C的简单阴离子多一个电子层。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E原子序数为26。回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)。
(1)E在周期表中的位置__________________________________________(指明周期和族)。
(2)A、B、C的第一电离能由小到大的顺序为__________________________________。
(3)B的氢化物的分子空间构型是________;AC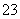 的中心原子采取________杂化。
的中心原子采取________杂化。
(4)写出任意一种由两种元素组成的与DC2中的阴离子互为等电子体的微粒的化学式________________________________________________________________________。
(5)E的高价态离子和低价态离子均能与A、B两元素按原子个数比1∶1形成的带一个单位负电荷的阴离子组成六配位的配离子。写出该配离子的化学式________________________(任写一种)。
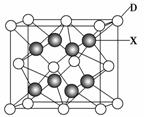
(6)X是周期表中电负性最大的元素,该元素与D元素组成的离子化合物的晶胞如下图所示。该离子化合物的化学式为________。
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第________周期、第________族;PbO2的酸性比CO2的酸性________(填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为_______________________。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为___________________;PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式为____________________,阴极上观察到的现象是____________________;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为______________________________,这样做的主要缺点是____________________。
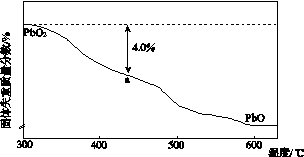
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%(即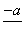 ×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m∶n值_______________________________________
×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m∶n值_______________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,在0.01 mol·L-1的硫酸溶液中,水电离出的H+浓度是 ( )
A.5×10-13 mol·L-1 B.0.02 mol·L-1
C.1×10-7 mol·L-1 D.1×10-12 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述及解释正确的是 ( )
A.2NO2(g)(红棕色)  N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
B.对于N2(g)+3H2(g) 2NH3(g),平衡后,保持压强不变,充入Ar,平衡左移
2NH3(g),平衡后,保持压强不变,充入Ar,平衡左移
C.FeCl3+3KSCN Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl固体,因为平衡向逆反应方向移动,故体系颜色变浅
Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl固体,因为平衡向逆反应方向移动,故体系颜色变浅
D.H2(g)+I2(g)  2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为 。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是 (写化学式),非金属气态氢化物还原性最强的是 (写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有______________
(写出其中两种物质的化学式)。
(4)ZX的电子式为 。[
查看答案和解析>>
科目:高中化学 来源: 题型:
氮氧化铝(AlON)属原子晶体,是一种超强透明材料,下列描述错误的是
A.AlON和石英的化学键类型相同
B.AlON和石英晶体类型相同
C.AlON和Al2O3的化学键类型不同
D.AlON和Al2O3晶体类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示:
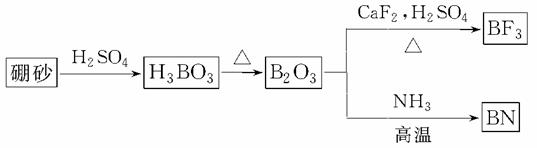
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是__________________________________、
___________________________________________________________________________;
(2)基态B___________________________________________________________________;
B和N相比,电负性较大的是________,BN中B元素的化合价为________;
(3)在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF 的立体构型为____________;
的立体构型为____________;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间化学键为____________,层间作用力为___________________________________________________________________;
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm。立方氮化硼晶胞中含有________个氮原子、________个硼原子,立方氮化硼的密度是________ g·cm-3(只要求列算式,不必计算出数值。阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在1 200 ℃时,天然气脱硫工艺中会发生下列反应
H2S(g)+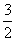 O2(g)===SO2(g)+H2O(g) ΔH1
O2(g)===SO2(g)+H2O(g) ΔH1
2H2S(g)+SO2(g)===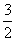 S2(g)+2H2O(g) ΔH2
S2(g)+2H2O(g) ΔH2
H2S(g)+ O2(g)===S(g)+H2O(g) ΔH3
O2(g)===S(g)+H2O(g) ΔH3
2S(g)===S2(g) ΔH4
则ΔH4的正确表达式为
A.ΔH4= (ΔH1+ΔH2-3ΔH3)
(ΔH1+ΔH2-3ΔH3)
B.ΔH4= (3ΔH3-ΔH1-ΔH2)
(3ΔH3-ΔH1-ΔH2)
C.ΔH4=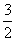 (ΔH1+ΔH2-3ΔH3)
(ΔH1+ΔH2-3ΔH3)
D.ΔH4=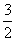 (ΔH1-ΔH2-3ΔH3)
(ΔH1-ΔH2-3ΔH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
乙酸香兰酯是用于调配奶油、冰淇淋的食用香精,其合成反应的化学方程式如下:
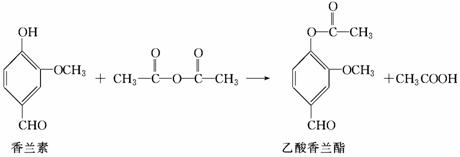
下列叙述正确的是( )
A.该反应属于取代反应
B.乙酸香兰酯的分子式为C10H8O4
C.FeCl3溶液可用于区别香兰素与乙酸香兰酯
D.乙酸香兰酯在足量NaOH溶液中水解得到乙酸和香兰素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com