
下列叙述及解释正确的是 ( )
A.2NO2(g)(红棕色)  N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
B.对于N2(g)+3H2(g) 2NH3(g),平衡后,保持压强不变,充入Ar,平衡左移
2NH3(g),平衡后,保持压强不变,充入Ar,平衡左移
C.FeCl3+3KSCN Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl固体,因为平衡向逆反应方向移动,故体系颜色变浅
Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl固体,因为平衡向逆反应方向移动,故体系颜色变浅
D.H2(g)+I2(g)  2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
科目:高中化学 来源: 题型:
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3的沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:

(1)W位于元素周期表第 周期第 族;W的原子半径比X的 (填“大”或“小”)。
(2)Z的第一电离能比W的 (填“大”或“小”);  油固态变为气态所需克服的微粒间作用力是 ;氢元素、
油固态变为气态所需克服的微粒间作用力是 ;氢元素、 、
、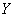 的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称 。
的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称 。
(3)震荡下,向Z单质与盐酸反应后的无色溶液中滴加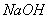 溶液直至过量,能观察到的现象是;
溶液直至过量,能观察到的现象是;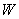 的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是 。
的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是 。
(4)在25°、101 下,已知13.5g的
下,已知13.5g的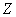 固体单质在
固体单质在 气体中完全燃烧后恢复至原状态,放热419
气体中完全燃烧后恢复至原状态,放热419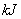 ,该反应的热化学方程式是 。
,该反应的热化学方程式是 。
25
查看答案和解析>>
科目:高中化学 来源: 题型:
已知0.1 mol•L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
A. 加少量烧碱溶液 B. 加醋酸钠 C. 加少量冰醋酸 D. 加水
查看答案和解析>>
科目:高中化学 来源: 题型:
已知胆矾溶于水时溶液温度降低,室温下将1mol无水硫酸铜制成溶液时放出热量为Q1kJ,又知胆矾分解的热化学方程式为CuSO4?5H2O(s) === CuSO4(s)+5H2O(l) △H=+Q2 kJ·mol-1则Q1、Q2的关系为 ( )
A.Q1<Q2 B. Q1>Q2 C. Q1=Q2 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组比值为1∶2的是( )
A.0.1 mol/L与0.2 mol/L醋酸溶液,c(H+)之比
B.0.1 mol/L H2S溶液,c(S2-)与c(H+)之比
C.pH=10的Ba(OH)2溶液与pH=10的氨水,溶质的物质的量浓度之比
D.pH=3的硫酸与pH=3的醋酸溶液,c(SO42-)与c(CH3COO-)之比
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC2的晶体为离子晶体,其阳离子与阴离子的个数比为1∶1,D的二价阳离子比C的简单阴离子多一个电子层。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E原子序数为26。回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)。
(1)E在周期表中的位置__________________________________________(指明周期和族)。
(2)A、B、C的第一电离能由小到大的顺序为__________________________________。
(3)B的氢化物的分子空间构型是________;AC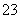 的中心原子采取________杂化。
的中心原子采取________杂化。
(4)写出任意一种由两种元素组成的与DC2中的阴离子互为等电子体的微粒的化学式________________________________________________________________________。
(5)E的高价态离子和低价态离子均能与A、B两元素按原子个数比1∶1形成的带一个单位负电荷的阴离子组成六配位的配离子。写出该配离子的化学式________________________(任写一种)。
(6)X是周期表中电负性最大的元素,该元素与D元素组成的离子化合物的晶胞如下图所示。该离子化合物的化学式为________。
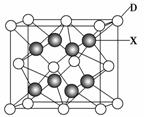
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2Zn(s)+O2(g)===2ZnO(s)
ΔH=-701.0 kJ·mol-1
2Hg(l)+O2(g)===2HgO(s) ΔH=-181.6 kJ·mol-1
则反应Zn(s)+HgO(s)===ZnO(s)+Hg(l)的ΔH为
A.+519.4 kJ·mol-1 B.+259.7 kJ·mol-1
C.-259.7 kJ·mol-1 D.-519.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物的结构为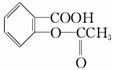 ,在一定条件下此有机物可能发生的反应有
,在一定条件下此有机物可能发生的反应有
( )
①中和反应 ②银镜反应 ③消去反应 ④酯化反应
⑤加成反应 ⑥水解反应
A.②③ B.①②③
C.①④⑤⑥ D.①③④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com