
已知胆矾溶于水时溶液温度降低,室温下将1mol无水硫酸铜制成溶液时放出热量为Q1kJ,又知胆矾分解的热化学方程式为CuSO4?5H2O(s) === CuSO4(s)+5H2O(l) △H=+Q2 kJ·mol-1则Q1、Q2的关系为 ( )
A.Q1<Q2 B. Q1>Q2 C. Q1=Q2 D. 无法确定
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
四种非金属主族元素M、X、Y、Z在周期表中相对位置如图,下列判断不正确的是
| X | ||
| Y | ||
| Z | M |
A.Z的氢化物中中心原子的杂化方式为sp3
B.Z原子的第一电离能小于M原子的第一电离能
C.四种元素全部位于p区
D.M、Y、Z最高价氧化物对应水化物的酸性从强到弱的顺序为:Y>M>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,在0.01 mol·L-1的硫酸溶液中,水电离出的H+浓度是 ( )
A.5×10-13 mol·L-1 B.0.02 mol·L-1
C.1×10-7 mol·L-1 D.1×10-12 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
在25℃的条件下,将体积都为10 mL,pH都等于3的醋酸和盐酸,加水稀释到a mL和b mL,测得稀释后溶液的pH均为5,则稀释时加入水的体积( )
A.a=b=10 mL B.a=b>10 mL
C.a<b D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述及解释正确的是 ( )
A.2NO2(g)(红棕色)  N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
B.对于N2(g)+3H2(g) 2NH3(g),平衡后,保持压强不变,充入Ar,平衡左移
2NH3(g),平衡后,保持压强不变,充入Ar,平衡左移
C.FeCl3+3KSCN Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl固体,因为平衡向逆反应方向移动,故体系颜色变浅
Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl固体,因为平衡向逆反应方向移动,故体系颜色变浅
D.H2(g)+I2(g)  2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为 。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是 (写化学式),非金属气态氢化物还原性最强的是 (写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有______________
(写出其中两种物质的化学式)。
(4)ZX的电子式为 。[
查看答案和解析>>
科目:高中化学 来源: 题型:
氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示:
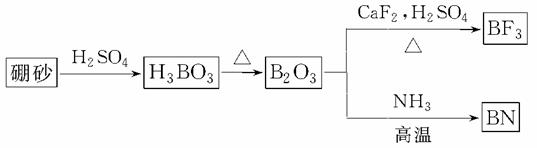
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是__________________________________、
___________________________________________________________________________;
(2)基态B___________________________________________________________________;
B和N相比,电负性较大的是________,BN中B元素的化合价为________;
(3)在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF 的立体构型为____________;
的立体构型为____________;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间化学键为____________,层间作用力为___________________________________________________________________;
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm。立方氮化硼晶胞中含有________个氮原子、________个硼原子,立方氮化硼的密度是________ g·cm-3(只要求列算式,不必计算出数值。阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了除去氯化钠样品中的杂质碳酸钠,某兴趣小组最初设计了如下方案并进行了实验。

(1)写出沉淀A的化学式___________________________;
(2)加入过量氯化钙溶液后,分离除去沉淀A的实验操作方法是____________________
_______________________________________________________________________。
(3)他们在实验过程中,又发现了新的问题:此方案很容易引入新的杂质,请写出固体物质B的成分________(用化学式表示);
(4)他们继续探究后又提出了新的方案:将混合物溶解,滴加盐酸至不再产生气体为止,既能除去碳酸钠杂质,又能有效地防止新杂质的引入。有关反应的化学方程式为
___________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com