
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为 。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是 (写化学式),非金属气态氢化物还原性最强的是 (写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有______________
(写出其中两种物质的化学式)。
(4)ZX的电子式为 。[
科目:高中化学 来源: 题型:
根据原子结构及元素周期律的知识,下列推断正确的是( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐减小
D. 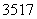 Cl与
Cl与 Cl得电子能力相同
Cl得电子能力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
要设计一套实验室利用液体和液体加热反应制备气体的装置,现设计了五步操作,正确的程序是( )
①将蒸馏烧瓶固定在铁架台上
②将酒精灯放在铁架台上,根据酒精灯确定铁圈高度,固定铁圈,放好石棉网
③用漏斗向蒸馏烧瓶中加入一种液体反应物,再向分液漏斗中加入另一种液体反应物,并将导气管放入气体收集器中
④检查装置的气密性(利用对固定装置微热的方法检查气密性)
⑤在蒸馏烧瓶上装好分液漏斗,连接好导气管
A.②①⑤④③ B.④①②⑤③
C.①②⑤④③ D.①⑤④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
已知胆矾溶于水时溶液温度降低,室温下将1mol无水硫酸铜制成溶液时放出热量为Q1kJ,又知胆矾分解的热化学方程式为CuSO4?5H2O(s) === CuSO4(s)+5H2O(l) △H=+Q2 kJ·mol-1则Q1、Q2的关系为 ( )
A.Q1<Q2 B. Q1>Q2 C. Q1=Q2 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
在t℃下,某反应达到平衡,平衡常数K=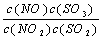 。恒容时,温度升高,NO浓度减小。下列说法正确的是 ( )
。恒容时,温度升高,NO浓度减小。下列说法正确的是 ( )
A.该反应的焓变为正值
B.K表达式中,C(SO3)指反应在该条件下达到化学平衡时SO3的物质的量浓度
C.升高温度,逆反应速率减小
D.该反应化学方程式为:NO+SO3 NO2+SO2
NO2+SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC2的晶体为离子晶体,其阳离子与阴离子的个数比为1∶1,D的二价阳离子比C的简单阴离子多一个电子层。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E原子序数为26。回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)。
(1)E在周期表中的位置__________________________________________(指明周期和族)。
(2)A、B、C的第一电离能由小到大的顺序为__________________________________。
(3)B的氢化物的分子空间构型是________;AC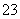 的中心原子采取________杂化。
的中心原子采取________杂化。
(4)写出任意一种由两种元素组成的与DC2中的阴离子互为等电子体的微粒的化学式________________________________________________________________________。
(5)E的高价态离子和低价态离子均能与A、B两元素按原子个数比1∶1形成的带一个单位负电荷的阴离子组成六配位的配离子。写出该配离子的化学式________________________(任写一种)。
(6)X是周期表中电负性最大的元素,该元素与D元素组成的离子化合物的晶胞如下图所示。该离子化合物的化学式为________。
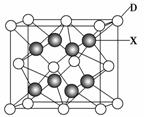
查看答案和解析>>
科目:高中化学 来源: 题型:
下表给出几种氯化物的熔点和沸点:
| NaCl | MgCl2 | AlCl3 | SiCl4 | |
| 熔点/℃ | 801 | 714 | 190 | -70 |
| 沸点/℃ | 1 413 | 1 412 | 180 | 57.57 |
有关表中所列四种氯化物的性质,有以下叙述:①氯化铝在加热时能升华,②四氯化硅在晶态时属于分子晶体,③氯化钠晶体中微粒之间以范德华力结合,④氯化铝晶体是典型的离子晶体。其中与表中数据一致的是
A.①② B.②③
C.①②④ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)
ΔH=-1 452 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l)
ΔH=-57.3 kJ·mol-1
下列说法正确的是
A.H2(g)的燃烧热为571.6 kJ·mol-1
B. H2SO4(aq)+
H2SO4(aq)+ Ba(OH)2(aq)===
Ba(OH)2(aq)=== BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
C.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
D.3H2(g)+CO2(g)===CH3OH(l)+H2O(l)
ΔH=+135.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某酯A,其分子式C6H12O2,已知
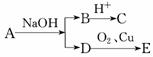
又知B、C、D、E均为有机物,D不与Na2CO3溶液反应,E不能发生银镜反应,则A结构可能有( )
A.5种 B.4种
C.3种 D.2种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com