
氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示:
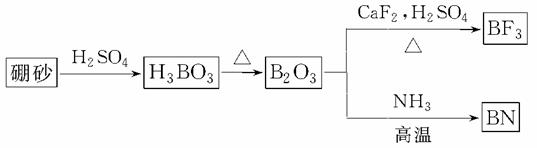
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是__________________________________、
___________________________________________________________________________;
(2)基态B___________________________________________________________________;
B和N相比,电负性较大的是________,BN中B元素的化合价为________;
(3)在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF 的立体构型为____________;
的立体构型为____________;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间化学键为____________,层间作用力为___________________________________________________________________;
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm。立方氮化硼晶胞中含有________个氮原子、________个硼原子,立方氮化硼的密度是________ g·cm-3(只要求列算式,不必计算出数值。阿伏加德罗常数为NA)。
解析 (1)已知反应物和主要的生成物,根据原子守恒判断出次要生成物,写出化学方程式,配平即可。
(2)B原子核外有5个电子,其基态电子排布式为1s22s22p1;BN中N的电负性较大,N为-3价,那么B就为+3价。
(3)因为BF3的空间构型为平面三角形,所以F—B—F的键角为120°。
(4)六方氮化硼晶体结构与石墨相似,故B、N以共价键相结合构成分子晶体,其层间作用力是分子间作用力。
答案 (1)B2O3+3CaF2+3H2SO4 2BF3↑+3CaSO4+3H2O B2O3+2NH3
2BF3↑+3CaSO4+3H2O B2O3+2NH3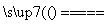 2BN+3H2O (2)1s22s22p1 N +3 (3)120° sp2 正四面体 (4)共价键(极性共价键) 分子间作用力 (5)4 4
2BN+3H2O (2)1s22s22p1 N +3 (3)120° sp2 正四面体 (4)共价键(极性共价键) 分子间作用力 (5)4 4 


 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22,下列说法正确的是( )
| X | Y | ||
| W | Z | ||
| T |
A.X、Y、Z三种元素最低价氢化物的沸点依次升高
B.由X、Y和氢三种元素形成的化合物中只有共价键
C.物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
已知胆矾溶于水时溶液温度降低,室温下将1mol无水硫酸铜制成溶液时放出热量为Q1kJ,又知胆矾分解的热化学方程式为CuSO4?5H2O(s) === CuSO4(s)+5H2O(l) △H=+Q2 kJ·mol-1则Q1、Q2的关系为 ( )
A.Q1<Q2 B. Q1>Q2 C. Q1=Q2 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC2的晶体为离子晶体,其阳离子与阴离子的个数比为1∶1,D的二价阳离子比C的简单阴离子多一个电子层。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E原子序数为26。回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)。
(1)E在周期表中的位置__________________________________________(指明周期和族)。
(2)A、B、C的第一电离能由小到大的顺序为__________________________________。
(3)B的氢化物的分子空间构型是________;AC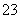 的中心原子采取________杂化。
的中心原子采取________杂化。
(4)写出任意一种由两种元素组成的与DC2中的阴离子互为等电子体的微粒的化学式________________________________________________________________________。
(5)E的高价态离子和低价态离子均能与A、B两元素按原子个数比1∶1形成的带一个单位负电荷的阴离子组成六配位的配离子。写出该配离子的化学式________________________(任写一种)。
(6)X是周期表中电负性最大的元素,该元素与D元素组成的离子化合物的晶胞如下图所示。该离子化合物的化学式为________。
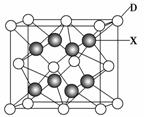
查看答案和解析>>
科目:高中化学 来源: 题型:
下表给出几种氯化物的熔点和沸点:
| NaCl | MgCl2 | AlCl3 | SiCl4 | |
| 熔点/℃ | 801 | 714 | 190 | -70 |
| 沸点/℃ | 1 413 | 1 412 | 180 | 57.57 |
有关表中所列四种氯化物的性质,有以下叙述:①氯化铝在加热时能升华,②四氯化硅在晶态时属于分子晶体,③氯化钠晶体中微粒之间以范德华力结合,④氯化铝晶体是典型的离子晶体。其中与表中数据一致的是
A.①② B.②③
C.①②④ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2Zn(s)+O2(g)===2ZnO(s)
ΔH=-701.0 kJ·mol-1
2Hg(l)+O2(g)===2HgO(s) ΔH=-181.6 kJ·mol-1
则反应Zn(s)+HgO(s)===ZnO(s)+Hg(l)的ΔH为
A.+519.4 kJ·mol-1 B.+259.7 kJ·mol-1
C.-259.7 kJ·mol-1 D.-519.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)
ΔH=-1 452 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l)
ΔH=-57.3 kJ·mol-1
下列说法正确的是
A.H2(g)的燃烧热为571.6 kJ·mol-1
B. H2SO4(aq)+
H2SO4(aq)+ Ba(OH)2(aq)===
Ba(OH)2(aq)=== BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
C.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
D.3H2(g)+CO2(g)===CH3OH(l)+H2O(l)
ΔH=+135.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列根据实验现象所得出的结论中,一定正确的是( )
A.无色溶液使蓝色石蕊试纸变红,结论:溶液显酸性
B.无色溶液焰色反应呈黄色,结论:溶液是钠盐溶液
C.无色溶液加入Na2CO3溶液产生白色沉淀,结论:溶液中含Ca(OH)2
D.溶液中加入氢氧化钠溶液,加热产生的气体使湿润的红色石蕊试纸变蓝,结论:溶液中含NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
A.液溴易挥发,在存放液溴的试剂瓶中应加水封
B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com