
【题目】下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。请根据装置图回答下列问题:

(1)将A、B、C、D 填入适当的空格中。
①从碘水中提取碘_______;
②分离酒精与水的混合物_______;
③除去粗盐中的泥沙________;
④与海水晒盐原理相符的是_________;
(2)装置A中仪器①的名称是_________________,冷却水是从______口进水(填“下”或“上”)。
【答案】C(或CA) A B D 冷凝管 下
【解析】
(1)A.装置是蒸馏装置,常用于沸点不同的液态混合物的分离,B.装置是过滤装置,常用于固体和液体混合物的分离,C.装置是分液装置,常用于互不相容的液体分离,D.装置是蒸发装置,常用于蒸发溶剂的方法分离固体溶质;
(2)用蒸馏装置,所涉及的仪器和实验操作过程,回答此题;
(1)①碘易溶于有机物溶剂,可用萃取的方法分离,故选C;
②酒精和水的沸点不同,分离酒精与水的混合物,应用蒸馏装置,故选A;
③泥沙不溶于水,可用过滤的方法分离,故选B;
④加热时使水挥发,可用蒸发的方法晒盐,故选D;
本题答案为:C ,A B D;
(2)装置A是蒸馏装置,其中仪器①的名称是:冷凝管,用其冷却时,冷水应从下口进,上口出;
本题答案为:冷凝管 , 下。


科目:高中化学 来源: 题型:
【题目】实验室从海带中提取碘的操作过程中,仪器选用不正确的是 ( )
选项 | A | B | C | D |
操作 | 称取3g左右的剪碎了的干海带 | 灼烧干海带碎片至完全变成灰烬 | 过滤煮沸后的海带灰与水的混合液 | 用四氯化碳从氧化后的海带灰浸取液中提取碘 |
选用仪器 | 托盘天平 | 蒸发皿 | 普通漏斗 | 分液漏斗 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过以下反应合成:Al2O3+N2+3C![]() 2AlN+3CO。有关该反应下列叙述正确的是
2AlN+3CO。有关该反应下列叙述正确的是
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. AlN中氮的化合价为+3
C. 上述反应中,每生成1 molAlN需转移3 mol电子
D. AlN的摩尔质量为41 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。试运用所学知识,回答下列问题:
(1)已知在一定温度下,①C(s)+CO2(g) ![]() 2CO(g) △H1=a kJ/mol 平衡常数K1;
2CO(g) △H1=a kJ/mol 平衡常数K1;
②CO(g)+H2O(g) ![]() H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;
H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;
某反应的平衡常数表达式K3=![]() ,请写出此反应的热化学方程式:__________,K1、K2、K3之间的关系是:_____________。
,请写出此反应的热化学方程式:__________,K1、K2、K3之间的关系是:_____________。
(2)将原料气按n(CO2):n(H2)=1:4置于密闭容器中发生CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)反应,测得H2O(g)的物质的量分数与温度的关系如图所示
CH4(g)+2H2O(g)反应,测得H2O(g)的物质的量分数与温度的关系如图所示
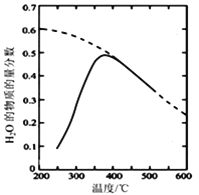 (虚线表示平衡曲线)。
(虚线表示平衡曲线)。
①该反应的平衡常数K随温度降低而________(填“增大”或“减小”)。
②在密闭恒温(高于100℃)恒容装置中进行该反应,下列能说明达到平衡状态的是_____。
A.混合气体密度不再改变
B.混合气体压强不再改变
C.混合气体平均摩尔质量不再改变
D. n(CO2):n(H2)=1:2
③200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算表达式为______。(不必化简,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)500℃时,CO与水反应生成CO2和H2。将CO2和H2分离得到H2的过程示意图如下。
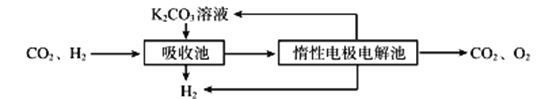
①吸收池中所有离子浓度的等式关系是____________________________。
②结合电极反应式,简述K2CO3溶液的再生原理:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C2H4O)是基础有机化工原料,由A可制备聚碳酸酯(D)及食用香精茉莉酮(部分反应条件略去)如下图所示:

已知A、B的核磁共振氢谱均只有1组峰
(1)A的名称为 _________ ;G中官能团的名称为 _______ 。
(2)②的反应类型为__________ ;③的反应类型为__________
(3)D的结构简式为 _______ 。
(4)反应①的化学方程式为 _______ 。
(5)G的一种同分异构体,能与FeCl3溶液发生显色反应,苯环上只有2个取代基且互为对位,则符合条件的异构体有 ____ 种,其中核磁共振氢谱只有5组峰的是 ___________(写结构简式)。
(6)依据上述合成路线,试以A和HC≡CLi为原料合成1,3-丁二烯(注明反应条件)_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】烃A的质谱图中,质荷比最大的数值为42。碳氢两元素的质量比为6:1,其核磁共振氢谱有三个峰,峰的面积比为1:2:3。A与其他有机物之间的关系如下:
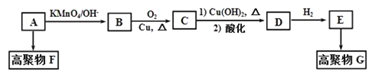
已知:CH2=CH2![]() HOCH2CH2OH,回答下列问题:
HOCH2CH2OH,回答下列问题:
(1)有机物B的分子式___________________________。
(2)高聚物F结构简式为___________________。
(3)写出C与新制的氢氧化铜反应的化学方程式___________________________。
(4)E在一定条件下可以相互反应生成一种六元环有机物H,H的结构简式________.。
(5)写出生成G的化学方程式_____________________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】龙癸醛是一种珍贵香料,广泛应用于香料、医药、染料及农药等行业。其合成路线如图所示(部分反应产物和反应条件已略去)。

回答下列问题:
(1)下列有关R和烯烃C3H6的说法正确的是__________________。(填代号)
A.它们的实验式相同 B.它们都能使溴水褪色
C.它们都能发生加成反应 D.它们都含有碳碳双键
(2)反应⑤的试剂和条件是___________________________;反应③的类型是_____________________。
(3)T所含官能团的名称是________;反应④的化学方程式为__________________________________。
(4)X的名称是____________________。
(5)遇氯化铁溶液发生显色反应的T的同分异构体有________种,其中,在核磁共振氢谱上有4组峰且峰面积比为1∶2∶3∶6的结构简式为_______________________________________________。
(6)参照上述流程图,以2—甲基—1,3—丁二烯为原料,经三步制备2—甲基—1,4—丁二醛,设计合成路线:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应“P4(s)+3NaOH(aq)+3H2O(l)=3NaH2PO2(aq)+PH3(g) ΔH>0”制得的NaH2PO2可用于化学镀镍。下列说法正确的是

A. P4分子中P原子均满足8电子稳定结构
B. 反应中NaOH作还原剂
C. 该反应能自发进行,则ΔS<0
D. 反应中生成1 mol NaH2PO2,转移电子数目为3×6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com