
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
A. 放电时负极失去电子,发生还原反应
B. 放电时电解质溶液中的OH-向正极移动
C. 充电时阴极附近溶液的pH减小
D. 充电时阳极反应:Ni(OH)2-e-+OH-===NiOOH+H2O
【答案】D
【解析】
A.原电池中,负极上发生失电子的氧化反应;
B.原电池中,电解质中的阴离子向负极移动;
C.电解池中,阴极发生得电子的还原反应,根据电极反应确定溶液溶液的的变化;
D.电解池中,与直流电源正极相连的电极是阳极,阳极发生失电子的氧化反应。
详解: A. 放电时是原电池工作原理,负极上发生失电子的氧化反应,故A错误;
B. 放电时是原电池的工作原理,原电池工作时,电解质中的阴离子向负极移动,故B错误;
C. 充电时是电解池的工作原理,电解池中,阴极发生得电子的还原反应,阴极附近溶液的pH增大,故C错误;
D. 充电时是电解池的工作原理,电解池中,与直流电源正极相连的电极是阳极,阳极发生失电子的氧化反应,即发生Ni(OH)2转化为NiOOH的反应,故D正确。
故选D。


科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的燃烧热为285.8 kJ/mol
N2(g) + 2O2(g)= 2NO2(g) △H= +133 kJ/mol
H2O(g) =H2O(l) △H= -44 kJ/mol
(1)催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为_____________。
Ⅱ.脱碳:
(2)向2L恒容密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应 CO2(g) + 3H2(g) ![]() CH3OH(l) + H2O(l)。下列叙述能说明此反应达到平衡状态的是__________。
CH3OH(l) + H2O(l)。下列叙述能说明此反应达到平衡状态的是__________。
A.混合气体的平均式量保持不变 B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等 D.混合气体的密度保持不变
E.1 mol CO2生成的同时有3 mol H—H键断裂
(3)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,发生反应CO(g) + 2H2(g) ![]() CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图所示。
CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图所示。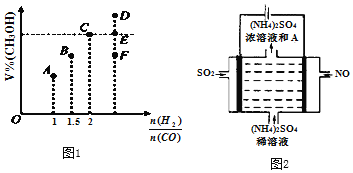
①当起始n(H2)/n(CO)=2,经过5min达到平衡,CO的转化率为0.4,则0~5min内平均反应速率V(H2)=___________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将__________(选填“增大”、“减小”或“不变”);
②当起始n(H2)/n(CO)=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_________点(选填“D”、“E”或“F”)
Ⅲ.脱硫:
(4)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为_______,阴极的电极反应式是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置完成了浓硫酸和SO2性质实验(夹持装置已省略)。请回答:
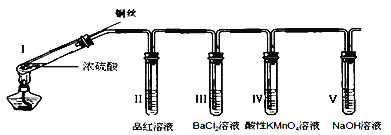
(1)下列说法正确的是__________。
A.反应后,将试管Ⅰ中的白色固体加入水中,溶液呈蓝色
B.取下试管Ⅲ并不断振荡,试管中出现浑浊,是因为生成了BaSO4
C.试管Ⅳ中KMnO4溶液褪色,说明SO2具有氧化性
D.试管V中的NaOH溶液可用Na2CO3溶液代替
(2)取下试管Ⅱ,在该试管口套上气球,将无色溶液加热恢复至红色,冷却后,发现溶液颜色再次变浅。解释“无色→红色→颜色变浅”变化的原因______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是化学对人类的一项重大贡献。
(1)某兴趣小组为研究电池原理,设计如图A装置。
|
|
A | B |
①a和b不连接时,烧杯中发生反应的离子方程式是___________________。
②a和b用导线连接,Cu极为原电池________(填“正”或“负”)极,该电极反应式是____________________________。
③无论a和b是否连接,Zn片均被腐蚀,若转移了0.4 mol电子,则理论上Zn片质量减轻________ g。
(2)如图B是甲烷燃料电池原理示意图,回答下列问题:
①电池的负极是________(填“a”或“b”)电极,该极的电极反应式为________________。
②电池工作一段时间后电解质溶液的pH________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知 W 的一种核素的质量数为18,中子数为10;X 和 Ne 的核外电子数相差1; 在Z所在的周期中,Z 元素的原子得电子能力最强;四种元素的最外层电子数之和为18。 请回答下列问题:
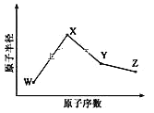
(1)X 元素位于元素周期表中位置为____________。
(2)Z 的同族简单氢化物中,稳定性最好的是________(写化学式),原因__________________。
(3)W、X、Z 三种元素形成的化合物中化学键类型为___________;X2W2的电子式为________。
(4)Y 与 Z 形成的化合物YZ4在常温下是一种液态,它和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式为__________________________。
(5)Z 的氧化物很多,其中一种黄绿色气体M,其氧含量为 47.41%,可用于水处理, M 在液态和浓缩气态时具有爆炸性。 M 可与 NaOH 溶液反应生成两种稳定的盐,它们的物质的量之比为 1︰5,该反应的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“保护地球,人人有责”。开发新能源,倡导低碳经济对环境保护有重要的意义与作用。下列说法不正确的是( )
A.CO2、甲烷都属于温室气体
B.太阳能、风能和生物能均属于新能源
C.太阳能电池可将太阳能直接转化为电能
D.用甘蔗生产的乙醇燃料属于可再生能源,利用乙醇燃料不会产生温室气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法不正确的是
A. 23g Na与O2充分反应生成Na2O和Na2O2的混合物,消耗O2的分子数N(O2)的范围为:0.25 NA< N(O2)< 0.5 NA
B. 2 mol NO和1 mol O2在密闭容器中充分反应,反应后容器中的分子数小于2NA
C. 2.5gMg-Zn合金与足量盐酸反应,放出的气体在标况下的体积可能为2.24L
D. 50 mL 18.4 mol/L浓硫酸与足量铜微热反应,转移的电子数目为0.92NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关过氧化氢的叙述正确的是( )
A. 过氧化氢是离子化合物
B. 过氧化氢分子只含有极性键
C. 过氧化氢分子只含有非极性键
D. 过氧化氢分子既含有非极性键又含有极性键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com