
【题目】“保护地球,人人有责”。开发新能源,倡导低碳经济对环境保护有重要的意义与作用。下列说法不正确的是( )
A.CO2、甲烷都属于温室气体
B.太阳能、风能和生物能均属于新能源
C.太阳能电池可将太阳能直接转化为电能
D.用甘蔗生产的乙醇燃料属于可再生能源,利用乙醇燃料不会产生温室气体
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】某红色固体粉末可能是Fe2O3、Cu2O或二者混合物,为探究其组成,称取mg该固体粉末样品,用足量的稀H2SO4充分反应后,称得固体质量为ag。
已知:Cu2O+2H+ = Cu+Cu2++H2O
(1)若a=____________(用含m的最简式表示),则红色固体粉末为纯净物;
(2)若a=m/9,则红色固体粉末中Fe2O3的物质的量为____________mol(用含m的最简式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
A. 放电时负极失去电子,发生还原反应
B. 放电时电解质溶液中的OH-向正极移动
C. 充电时阴极附近溶液的pH减小
D. 充电时阳极反应:Ni(OH)2-e-+OH-===NiOOH+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶液中:氧化性IO3—>I2>SO32-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,下列说法正确的是
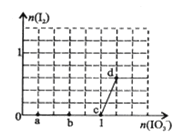
A. a点反应的还原剂是NaHSO3,被氧化的元素是碘元素
B. b点反应的离子方程式是:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O
C. c点到d点的反应中共转移0.6mol电子
D. 往200mL 1 mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式是:5 HSO3- + 2IO3- == I2+ 5SO42-+ 3H++ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类法是一种行之有效、简单易行的科学方法,人们在认识事物时可以采取多种分类方法。下列关于“Na2CO3”的分类不正确的是 ( )
A.电解质B.碳酸盐C.钠盐D.碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)NH3经一系列反应可以得到HNO3和NH4NO3,如图所示,

在Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是:__________________________

(2)Ⅱ中,2NO(g)+ O2(g) 2NO2(g).在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图).
①p1、p2的大小关系p1 ________ p2(填大于、等于、小于) .
②随温度升高,该反应平衡常数变化的趋势是_________________________
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(1)再制备浓硝酸.
N2O4与O2, H2O化合的化学方程式是______________________________
(4)Ⅳ中,电解NO制备NH4NO3,其原理原理如下图所示,为使电解产物全部转化为NH4NO3, 需补充物质___________ ,说明理由:___________________.
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.纳米级Cu2O既是航母舰艇底部的防腐蚀涂料,也是优良的催化剂。
(1)已知:C(s)+![]() O2(g)=CO(g)ΔH =–110.4kJmol-1,
O2(g)=CO(g)ΔH =–110.4kJmol-1,
2Cu2O(s)+O2(g)= 4CuO(s) ΔH =–292kJmol-1,则工业上用碳粉与CuO粉末混合在一定条件下反应制取Cu2O(s),同时生成CO气体的热化学方程式为________。
(2)用纳米级Cu2O作催化剂可实现甲醇脱氢制取甲醛:
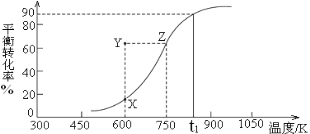
CH3OH(g)![]() HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如右图所示。
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如右图所示。
①该反应的ΔH___0 (填“>”或“<”);600K时,Y点甲醇的v(正) ____v(逆)(填“>”或“<”)。
②从Y点到X点可采取的措施是___________________________________。
③在t1K时,向固定体积为2L的密闭容器中充入1molCH3OH(g),温度保持不变,9分钟时达到平衡,则0~9min内用CH3OH(g)表示的反应速率v(CH3OH)=_____________, 温度为t1时,该反应的平衡常数K=____________。
Ⅱ.金属铜因导电性强而应用广泛。
由黄铜矿冶炼得到的粗铜经过电解精炼才能得到纯铜。电解时,粗铜作______极,阴极的电极反应式为_______________。
Ⅲ.含铜离子的的废水会造成污染,通常将其转化为硫化铜沉淀而除去。
已知:Ksp[CuS]=1×10-36,要使铜离子的浓度符合排放标准(不超过0.5mg/L),溶液中的硫离子的物质的量浓度至少为__________mol/L(保留至小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)可用于汽车安全气囊的添加剂,与酸反应生成N2和H2。某学习小组在实验室用亚硝酸钠和氨在无氧环境中制备NaN3,设计如下实验(夹持装置略去):

(1)按气流从左到右的方向,上述装置合理的连接顺序为_________________(填仪器接口字母)。
(2)试剂X可选用________________(填试剂名称)。
(3)装置C中发生反应的化学方程式为_________________________________________,该反应需要在无氧环境中进行的原因为_______________________________________________。
(4)装置B的作用为___________________________________________。
(5)加热条件下,NaNH2和N2O反应也可制备NaN3,同时生成能使湿响的红色石蕊试纸变蓝的气体,该反应的化学方程式为_____________________________________________。
(6)HNO2是一元弱酸,不稳定,容易分解为两种氮的氧化物。现用如下试剂:NaNO2、pH试纸、水、稀硫酸、NaOH溶液、碱石灰、CuSO4、CuO,计实验证明((可加热);
①HNO2为弱酸:____________________________________________________。
②装置C中反应进行一段时间后,有NaN3生成:______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com