
【题目】某红色固体粉末可能是Fe2O3、Cu2O或二者混合物,为探究其组成,称取mg该固体粉末样品,用足量的稀H2SO4充分反应后,称得固体质量为ag。
已知:Cu2O+2H+ = Cu+Cu2++H2O
(1)若a=____________(用含m的最简式表示),则红色固体粉末为纯净物;
(2)若a=m/9,则红色固体粉末中Fe2O3的物质的量为____________mol(用含m的最简式表示)。
【答案】![]()
![]()
【解析】
(1)红色固体粉末为纯净物只有两种情况,全是Fe2O3或者全是Cu2O。Cu2O和硫酸反应生成的Cu会与Fe3+反应,Cu+2Fe3+=Cu2++2Fe2+。若全为Fe2O3时,剩余的固体物质为a=0g,但是当剩余固体质量为0g时,也有可能是Fe2O3和Cu2O两种物质的混合物;所以该红色固体只能为Cu2O。
Cu2O+2H+=Cu+Cu2++H2O
![]()
![]()
![]() ,所以a=
,所以a=![]() m
m
(2)设Fe2O3为 x mol, Cu2O为ymol,则160x+144y=m,Cu2O+2H+=Cu+Cu2++H2O得到的铜为ymol。
Cu+2Fe3+=Cu2++2Fe2+
x mol 2x mol
剩余的铜的质量为(y-x)×64=a=![]() m,方程式联立,解出x=
m,方程式联立,解出x=![]() 。
。


 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)CH3OH(g)。按n(CO):n(H2)=1:2,向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法中,正确的是
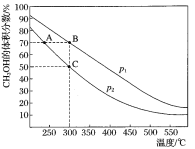
A. p1<p2
B. 该反应的ΔH>0
C. 平衡常数:K(A)=K(B)
D. 在C点时,CO转化率为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向饱和苛性钠溶液中放一定量的过氧化钠,充分反应后恢复到原温度,下列有关说法中,正确的是
A.溶液中Na+浓度增大,有O2放出B.溶液pH不变,有H2放出
C.溶液中Na+数目减少,有O2放出D.溶液中pH增大,有O2放出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置完成了浓硫酸和SO2性质实验(夹持装置已省略)。请回答:
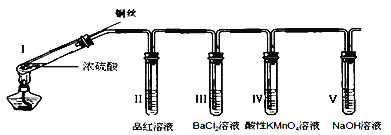
(1)下列说法正确的是__________。
A.反应后,将试管Ⅰ中的白色固体加入水中,溶液呈蓝色
B.取下试管Ⅲ并不断振荡,试管中出现浑浊,是因为生成了BaSO4
C.试管Ⅳ中KMnO4溶液褪色,说明SO2具有氧化性
D.试管V中的NaOH溶液可用Na2CO3溶液代替
(2)取下试管Ⅱ,在该试管口套上气球,将无色溶液加热恢复至红色,冷却后,发现溶液颜色再次变浅。解释“无色→红色→颜色变浅”变化的原因______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4在生产和生活中有着广泛的用途。某化学小组在实验室制备KMnO4并探究其性质。请回答下列问题:
(一)KMnO4的制备。
步骤I 先利用如图甲所示装置由MnO2制备KMnO4。
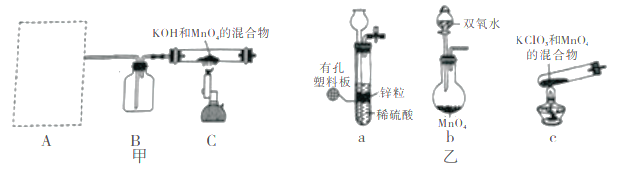
(1)装置A应选用图乙中的_______(填“a”“b”或“c”)。
(2)装置B中所盛试剂的名称为________。
(3)装置C处制备K2MnO4的化学方程式为________。
步骤II 由K2MnO4制备KMnO4。已知:K2MnO4易溶于水,水溶液呈墨绿色。主要过程如下:
①充分反应后,将装置C处所得固体加水溶解,过滤;
②向①的滤液中通入足量CO2,过滤出生成的MnO2;
③将②的滤液经过蒸发浓缩、降温结晶、过滤、洗涤、干燥等一系列实验操作,得KMnO4晶体。
(4)过程②向①的滤液中通人足量CO2,其还原产物为_______。
(5)过程③干燥KMnO4时,温度不宜过高的原因是__________。
(二)KMnO4的性质。
KMnO4具有强氧化性。某化学学习小组利用其性质测定H2C2O4溶液的浓度。
反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(6)①滴定终点现象是:当加入最后一滴酸性KMnO4溶液时,溶液颜色______,且半分钟内不褪色。
②c(标准KMnO4溶液)=0.20mol/L,滴定时所得的实验数据如下表,试计算所测H2C2O4溶液的浓度为_______mol/L。
实验次数编号 | 待测液体积(mL) | 滴入的标准液体积(mL) |
1 | 10.00 | 22.95 |
2 | 10.00 | 20.05 |
3 | 10.00 | 19.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是化学对人类的一项重大贡献。
(1)某兴趣小组为研究电池原理,设计如图A装置。
|
|
A | B |
①a和b不连接时,烧杯中发生反应的离子方程式是___________________。
②a和b用导线连接,Cu极为原电池________(填“正”或“负”)极,该电极反应式是____________________________。
③无论a和b是否连接,Zn片均被腐蚀,若转移了0.4 mol电子,则理论上Zn片质量减轻________ g。
(2)如图B是甲烷燃料电池原理示意图,回答下列问题:
①电池的负极是________(填“a”或“b”)电极,该极的电极反应式为________________。
②电池工作一段时间后电解质溶液的pH________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“保护地球,人人有责”。开发新能源,倡导低碳经济对环境保护有重要的意义与作用。下列说法不正确的是( )
A.CO2、甲烷都属于温室气体
B.太阳能、风能和生物能均属于新能源
C.太阳能电池可将太阳能直接转化为电能
D.用甘蔗生产的乙醇燃料属于可再生能源,利用乙醇燃料不会产生温室气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中表示碳原子相互结合的几种方式。小圆球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢原子结合,则下列说法正确的是
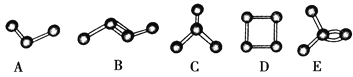
A. 图中属于烷烃的是A、C、D
B. 图中C和E分子中氢原子数相同
C. 图中物质碳元素的质量分数最小的是A
D. 图中与B互为同分异构体的有C、D、E
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com