
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的燃烧热为285.8 kJ/mol
N2(g) + 2O2(g)= 2NO2(g) △H= +133 kJ/mol
H2O(g) =H2O(l) △H= -44 kJ/mol
(1)催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为_____________。
Ⅱ.脱碳:
(2)向2L恒容密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应 CO2(g) + 3H2(g) ![]() CH3OH(l) + H2O(l)。下列叙述能说明此反应达到平衡状态的是__________。
CH3OH(l) + H2O(l)。下列叙述能说明此反应达到平衡状态的是__________。
A.混合气体的平均式量保持不变 B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等 D.混合气体的密度保持不变
E.1 mol CO2生成的同时有3 mol H—H键断裂
(3)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,发生反应CO(g) + 2H2(g) ![]() CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图所示。
CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图所示。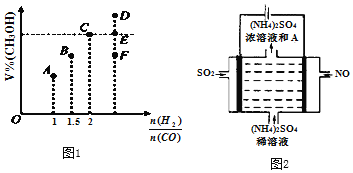
①当起始n(H2)/n(CO)=2,经过5min达到平衡,CO的转化率为0.4,则0~5min内平均反应速率V(H2)=___________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将__________(选填“增大”、“减小”或“不变”);
②当起始n(H2)/n(CO)=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_________点(选填“D”、“E”或“F”)
Ⅲ.脱硫:
(4)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为_______,阴极的电极反应式是_______________________。
【答案】4H2(g)+2NO2(g)=N2(g)+4H2O(g) △H= -1100.2kJ/mol DE 0.08mol/(L.min) 减小 F H2SO4 NO+6H++5e-=NH4++H2O
【解析】
Ⅰ.(1)写出氢气燃烧热表示的热化学方程式,依次编号,①×4-②-③×4得到催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式;
(2)可逆反应到达平衡时,正逆反应速率相等,各组分的浓度、含量不变,由此衍生的其它一些物理量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化,说明到达平衡;
(3)①由CO与氢气总物质的量、与n(H2)/n(CO)=2可以计算CO与氢气各物质的量,利用三段式计算平衡时各组分物质的量、各组分物质的量变化量,根据v=△c/△t计算v(H2);先计算该温度下平衡常数K,再计算浓度商Qc,与平衡常数K相比判断反应进行分析,可以确定氢气转化率变化;
②混合比例等于化学计量数之比时,平衡时生成物的含量最大;
Ⅲ.电解装罝可将雾霾中的NO、SO2分别转化为NH4+和SO42-,则电解方程式为5SO2+2NO+8H2O![]() (NH4)2SO4+4H2SO4,根据电解方程式结合电解原理分析。
(NH4)2SO4+4H2SO4,根据电解方程式结合电解原理分析。
Ⅰ.(1)已知:燃烧热为285.8kJ·mol-1,
①H2(g)+1/2O2(g)=H2O(l)△H=-285.8kJ·mol-1
②N2(g)+2O2(g)=2NO2(g)△H=+133kJ·mol-1
③H2O(g)=H2O(l)△H=-44kJ·mol-1
①×4-②-③×4得到催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ·mol-1;
(2)CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l),
CH3OH(l)+H2O(l),
A、向2L密闭容器中加入2mol CO2、6mol H2,按照1:3反应,生成物全呈液态,混合气体的平均式量始终保持不变,不能说明反应达到平衡状态,故A错误;
B、向2L密闭容器中加入2mol CO2、6mol H2,按照1:3反应,所以过程中CO2和H2的体积分数始终保持不变,故B错误;
C、向2L密闭容器中加入2mol CO2、6mol H2,按照1:3反应,CO2和H2的转化率始终相等,不能确定反应是否达到平衡状态,故C错误;
D、反应物是气体,生成物是液体,混合气体的密度保持不变,说明反应达到平衡状态,故D正确;
E、1mol CO2生成的同时有3mol H-H键断裂,说明正逆反应速率相同,反应达到平衡状态,故E正确;
故答案为:DE;
(3)①H2和CO总共为3mol,且起始n(H2)/n(CO)=2,可知H2为2mol、CO为1mol,5min达到平衡时CO的转化率为0.4,则:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始(mol):1 2 0
变化(mol):0.4 0.8 0.4
平衡(mol):0.6 1.2 0.4
容器的容积为2L,则v(H2)=0.8mol/(2L×5min)=0.08mol/(L·min),
该温度下平衡常数K=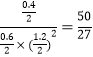 ,此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,此时浓度商Qc=
,此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,此时浓度商Qc=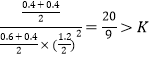 ,反应向逆向反应进行,达新平衡时H2的转化率将减小;
,反应向逆向反应进行,达新平衡时H2的转化率将减小;
②混合比例等于化学计量数之比时,平衡时生成物的含量最大,故当n(H2)/n(CO)=3.5时,达到平衡状态后,CH3 OH的体积分数小于C点,故选F。
(4)电解装罝可将雾霾中的NO、SO2分别转化为NH4+和SO42-,则电解方程式为5SO2+2NO+8H2O![]() (NH4)2SO4+4H2SO4,由电解方程式可知,物质A为硫酸,其化学式为H2SO4;电解时,阳极上二氧化硫失电子生成硫酸根离子,则阳极的电极反应式是SO2+2H2O-2 e-═SO42-+4H+,阴极电极反应为:NO+6H++5e-=NH4++H2O。
(NH4)2SO4+4H2SO4,由电解方程式可知,物质A为硫酸,其化学式为H2SO4;电解时,阳极上二氧化硫失电子生成硫酸根离子,则阳极的电极反应式是SO2+2H2O-2 e-═SO42-+4H+,阴极电极反应为:NO+6H++5e-=NH4++H2O。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强(提示:Na2S +2HCl = 2NaCl+ H2S↑),某化学实验小组设计了如下实验,请回答下列问题:
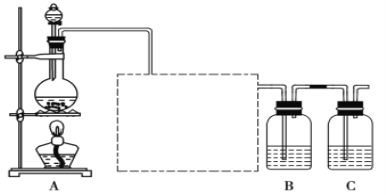
(1)画出虚线框内的实验装置图____,所加试剂为___________,该装置的作用是__________。
(2)装置B中盛放的试剂是____(填序号),
A.Na2S溶液B.Na2SO3溶液C.Na2SO4溶液
B装置中发生反应的离子方程式为___________________________。
(3)已知:①硫原子与氯原子的电子层数相同,氯的原子半径小于硫原子。②高氯酸的酸性比硫酸强;③铁与氯气在加热条件下反应生成三氯化铁,铁与硫在加热条件下反应生成硫化亚铁;④HCl比H2S稳定;⑤硫酸比次氯酸稳定;能说明氯的非金属性比硫强的是____(填序号)。
A.全部 B. ①②③④ C.①②④⑤ D. ①③④⑤
(4)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气,写出该装置中所发生反应的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被誉为“矿石熊猫”的香花石,由我国地质学家首次发现,它由前20号元素中的6种组成,分别为X、Y、Z、W、R、T。其中Ⅹ、Y、Z为金属元素,Z的最外层电子数与次外层电子数相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是
A. 原子半径:Y>Z>R>T
B. 气态氢化物的稳定性:W<R<T
C. 最高价氧化物对应的水化物的碱性:X>Z
D. XR2、WR2两种化合物中R的化合价相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】植物提取物-香豆素,可用于消灭鼠害。其分子球棍模型如图所示。由C、H、0三种元素组成。下列有关叙述不正确的是( )
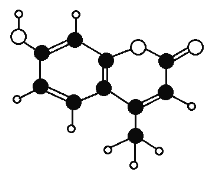
A. 该分了中不含手性碳原子
B. 分子式为C10H8O3
C. 能使酸性KMnO4溶液褪色
D. lmol香豆素最多消耗2molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl据此,某学生设计了下列实验。
【制备NaClO溶液】实验装置如下图图甲所示(部分夹持装置已省略)
已知:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3
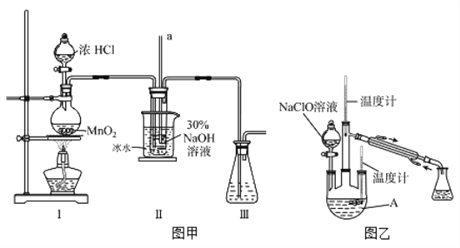
(1)配制30 %NaOH溶液时,所需玻璃仪器除量筒外还有__________(填字母)。
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置I中发生的离子反应方程式是_______________;Ⅱ中玻璃管a的作用为____________;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的___________________
【制取水合肼】实验装置如上图图乙所示
(3)反应过程中,如果分液漏斗中溶液的滴速过快, 部分N2H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式____________________;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
【测定肼的含量】
(4)称取馏分0.3000 g,加水配成20.0 mL溶液,一定条件下用0.1500 mol·L-1的I2溶液滴定。已知: N2H4·H2O + 2I2 = N2↑+ 4HI + H2O。
①滴定时,可以选用的指示剂为____________;
②实验测得消耗I2溶液的平均值为20. 00 mL,馏分中N2H4·H2O的质量分数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铝及其化合物的说法中不正确的是
A.氧化铝可用于工业制铝
B.氧化铝可用于制造耐火材料
C.明矾是一种常见的净水剂
D.铝槽车可用于稀硝酸的贮运
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象或新技术应用中,不涉及胶体性质的是( )
①在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀
②使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血
③清晨,在茂密的树林中,常常可以看到从枝叶间透过的一道道光柱
A.只有①B.①和②
C.②和③D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
A. 放电时负极失去电子,发生还原反应
B. 放电时电解质溶液中的OH-向正极移动
C. 充电时阴极附近溶液的pH减小
D. 充电时阳极反应:Ni(OH)2-e-+OH-===NiOOH+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com