
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一密闭容器中进行,则下列说法或结论中,正确是( )
CO(g)+H2(g)在一密闭容器中进行,则下列说法或结论中,正确是( )
A.保持压强不变,充入少量氦气,反应速率会减小
B.若v(CO)=v(H2O),则反应达平衡状态
C.其他条件不变,适当增加C(s)的质量会使反应速率增大
D.其他条件不变,仅将容器的体积缩小一半,反应速率减小
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】利用下图实验装置进行有关实验,下列对结论的叙述正确的是
选项 | ①中试剂 | ②中试剂 | 结论 |
|
A | 镁条、蒸馏水 | 肥皂水 | ②中开始出现气泡,说明①中生成了氢气 | |
B | 铜片、硝酸溶液 | 蒸馏水 | ②中试管口出现红棕色气体,说明①中生成了NO2 | |
C | 二氧化锰、浓盐酸 | 淀粉KI溶液 | 该装置可以用来检验①中是否产生了氯气 | |
D | 乙醇、乙酸、浓硫酸 | 饱和NaOH溶液 | 该装置可以用来制备乙酸乙酯 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.红褐色固体![]() 全部溶于氢碘酸:
全部溶于氢碘酸:![]()
B.水杨酸溶于![]() 溶液中:
溶液中:![]()
C.将等浓度的![]() 溶液与
溶液与![]() 液按体积比2:3混合:
液按体积比2:3混合:![]()
D.洁厕灵(含![]() )与84消毒液混合后产生氯气:
)与84消毒液混合后产生氯气:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁和铝分别与等浓度等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如图所示,则下列关于反应中镁和铝的叙述正确的是

A. 二者物质的量之比为3∶2
B. 二者质量之比为3∶2
C. 二者摩尔质量之比为2∶3
D. 二者消耗H2SO4的物质的量之比为2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程示意图如图:

下列说法中错误的是( )
A.过程①→②是吸热反应
B.Ni是该反应的催化剂
C.过程①→②既有碳氧键的断裂,又有碳氧键的形成
D.反应的总化学方程式可表示为:CH4+CO2![]() 2CO+2H2
2CO+2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院一项新研究成果实现了甲烷高效生产乙烯,其反应为:2CH4(g)![]() C2H4(g)+2H2(g) ΔH>0
C2H4(g)+2H2(g) ΔH>0
物质 | 燃烧热(kJ/mol) |
氢气 | 285.8 |
甲烷 | 890.3 |
乙烯 | 1411.5 |
(1)已知相关物质的燃烧热如表,完成热化学方程式:2CH4(g)![]() C2H4(g)+2H2(g) ΔH=__。
C2H4(g)+2H2(g) ΔH=__。
(2)温度为T1℃时,向1 L的恒容反应器中充入2 mol CH4,仅发生上述反应,反应0~15 min CH4的物质的量随时间变化如图1,实验测得10~15 min时H2的浓度为1.6 mol/L。

①若图1中曲线a、b分别表示在T1℃时,使用等质量的两种不同的催化剂时,达到平衡过程中n(CH4)变化曲线,判断:催化剂a_____b(填“优于”或“劣于”)。
②在15 min时改变反应条件,导致n(CH4)发生变化(见图1),则改变的条件可能是:_____(任答一条即可)。
(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),其中k正、k逆为速率常数仅与温度有关,温度为![]() 时,k正与k逆的比值为______(填数值)。若将温度由T1升高到T2,则反应速率增大的倍数v正_______ v逆(填“>”、“=”或“<”),判断的理由是_________。
时,k正与k逆的比值为______(填数值)。若将温度由T1升高到T2,则反应速率增大的倍数v正_______ v逆(填“>”、“=”或“<”),判断的理由是_________。
(4)科研人员设计了甲烷燃料电池并用于电解(如图2)。电解质是掺杂了Y2O3与ZrO2的固体,可在高温下传导O2-。
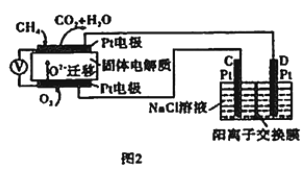
①图中C处的Pt为_______(填“阴”或“阳”)极。
②该电池工作时负极的电极反应式为________。
③用该电池电解饱和食盐水,一段时间后收集到标准状况下气体总体积为112 mL,则阴极区所得溶液在25℃时pH=_______(假设电解前后NaCl溶液的体积均为500 mL)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用标准盐酸测定某NaOH溶液的浓度,用酚酞作指示剂,下列操作可能使测定结果偏低的是
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2—3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色变化由红色变无色时,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2—3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示。下列说法正确的是
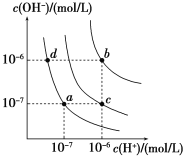
A. 图中对应点的温度关系为a>b>c
B. 纯水仅升高温度,可从a点变到c点
C. 水的离子积常数Kw数值大小关系为b>c>d
D. 在b点对应温度下,0.5 mol/L的H2SO4溶液与1 mol/L的KOH溶液等体积混合,充分反应后,所得溶液的c(H+)=1.0×107 mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E 元素的周期序数与主族序数相等。
(1)E 元素在周期表中的位置___________。
(2)写出A2W2的电子式为____________。
(3)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式________。
(4)元素D的单质在一定条件下,能与 A 单质化合生成一种化合物DA,熔点为800℃,DA能与水反应放氢气,若将1molDA和1molE 单质混合加入足量的水,充分反应后成气体的体积是_________(标准状况下)。
(5)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com