
【题目】利用下图实验装置进行有关实验,下列对结论的叙述正确的是
选项 | ①中试剂 | ②中试剂 | 结论 |
|
A | 镁条、蒸馏水 | 肥皂水 | ②中开始出现气泡,说明①中生成了氢气 | |
B | 铜片、硝酸溶液 | 蒸馏水 | ②中试管口出现红棕色气体,说明①中生成了NO2 | |
C | 二氧化锰、浓盐酸 | 淀粉KI溶液 | 该装置可以用来检验①中是否产生了氯气 | |
D | 乙醇、乙酸、浓硫酸 | 饱和NaOH溶液 | 该装置可以用来制备乙酸乙酯 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】在500mLKNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是
A.电解得到的Cu的物质的量为0.5mol
B.向电解后的溶液中加入98g的Cu(OH)2可恢复为原溶液
C.原混合溶液中c(K+)=4mol/L
D.电解后溶液中c(H+)=2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业上以粗铜为原料采取如下图所示流程制备硝酸铜晶体:

①在步骤a中,还需要通入氧气和水,其目的是___________________________。
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在____________范围。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ Cu2+ | 1.9 4.7 | 3.2 6.7 |
不用加水的方法调节溶液pH的原因是_______________________________________。
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明)
_________________________________________________________________________。
(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是______________________。
(3)下图是某小组同学查阅资料所绘出的硝酸铜晶体[ Cu(NO3)2·nH2O ]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是__________(填字母)。

a.A点时的溶液为不饱和溶液
b.B点时两种晶体可以共存
c.按上述流程最终得到的晶体是Cu(NO3)2·3H2O
d.若将C点时的溶液降温至30℃以下,可以析出Cu(NO3)2·6H2O晶体
(4)某些共价化合物(如H2O、NH3、N2O4等)在液态时有微弱的导电性,主要是因为发生了电离,如:2NH3![]() NH
NH![]() +NH
+NH![]() ,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是______________________________________;Cu与液态N2O4反应制得无水硝酸铜的化学方程式是______________________________________。
,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是______________________________________;Cu与液态N2O4反应制得无水硝酸铜的化学方程式是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 对于吸热反应,生成物总能量一定低于反应物总能量
B. 石墨和金刚石完全燃烧的化学方程式均可表示为“C+O2![]() CO2”,故相同条件下,12g的石墨和金刚石充分燃烧放出的热量相等
CO2”,故相同条件下,12g的石墨和金刚石充分燃烧放出的热量相等
C. 一定条件下,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3,放热19.3 kJ,据此实验事实可知:该条件下,每生成1mol NH3,放热19.3 kJ
D. 4 HCl(g)+O2(g)=2Cl2(g)+2H2O(g)是放热反应,Cl-Cl键和O=O键的键能分别为243kJ/mol和498kJ/mol,则可推算出H-O键的键能比H-Cl键的键能大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10mL0.1 mol/L的醋醵溶液中逐滴加入等浓度的NaOH溶液,溶液中pH与pOH[pOH=-lgc (OH-)]的变化关系如图所示。则下列说法正确的是
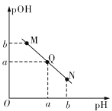
A. 两者恰好反应完全,需要NaOH溶液的体积大于10mL
B. Q点时溶液的pH=7
C. M点时溶液呈碱性,对水的电离起抑制作用
D. N点所示溶液中,c(CH3COO-)>c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明碳酸的酸性比硅酸强的事实是
A. 二氧化碳溶于水且能反应生成碳酸,二氧化硅不溶于水不能与水反应生成硅酸
B. 在高温下,二氧化硅与碳酸钠能发生反应:SiO2+Na2CO3![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
C. 二氧化硅的熔点比二氧化碳的熔点高
D. 二氧化碳通入硅酸钠溶液中,生成白色胶状沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是重要的化工原料,可由乙烯、乙炔为原料合成。反应过程如下所示:
乙炔聚合:3C2 H2 (g)![]() C6H6 (g) H1
C6H6 (g) H1
合成乙苯:C6H6(g)+C2H4(g)![]() C6H5CH2CH3(g) H2
C6H5CH2CH3(g) H2
乙苯脱氢:C6H5CH2CH3(g)![]() C6H5CH=CH2 (g)+H2 (g) △H3
C6H5CH=CH2 (g)+H2 (g) △H3
(1)乙苯脱氢是合成苯乙烯的关键步骤。某温度下,向2.0 L恒容密闭容器中充入0.10mol C6H5CH2CH3 (g),测得乙苯脱氢反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
①计算该温度下的平衡常数K= ______(结果保留至小数点后两位)。
②下列不能说明该温度下反应达到平衡状态的是_____(填字母代号)。
a.v(C6H5CH2CH3)=v(H2) b.苯乙烯的体积分数不变
c.平衡常数K保持不变 d.混合气体的平均相对分子质量不变
(2)向体积为3.0 L的恒容密闭容器中充入0. 20 mol C6H5CH2CH3(g),当乙苯脱氢反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示。

①该反应的H3______0(填“大于”“等于”或“小于”)。
②该平衡体系在600℃时,乙苯的物质的量分数为50%,则氢气的物质的量分数为_____。若在此温度下加入水蒸气作稀释剂,则乙苯的平衡转化率将如何变化并简述理由__________。
(3)苯乙烯能与酸性KMnO4溶液混合反应生成苯甲酸(C6H5COOH)。室温下,向饱和苯甲酸溶液中加入碳酸氢钠固体使溶液显中性,则溶液中c(C6H5COOH):c(C6H5COO-)=___________。(已知:苯甲酸的Ka=6.4×l0-5;碳酸的Kal=4.2×l0-7,Ka2=5.6×l0-ll)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关细胞中元素和化合物的叙述错误的是
A. 休眠的种子比萌发的种子结合水含量高
B. 镁是参与叶绿素合成的微量元素
C. 蛋白质和脂质是所有细胞共有的化合物
D. 磷脂和胆固醇均属于组成动物细胞膜的脂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝土矿主要含Al2O3和SiO2。某课题组以此为原料回收氧化铝,设计实验流程如下:
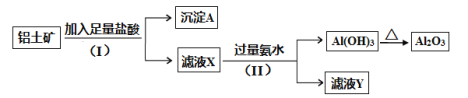
(1)步骤(I)中分离溶液和沉淀的操作名称是_____,实验中除了烧杯和玻璃棒外,还需要用到的玻璃仪器是_____。
(2)沉淀A中一定含有_________(用化学式表示),该物质属于________(填 “酸性”或“碱性”)氧化物。
(3)写出步骤(Ⅱ)中生成Al(OH)3的离子方程式___________________。
(4)实验室里用Na[Al(OH)4]溶液制取Al(OH)3最好选用__________(填序号)。
A.NaOH溶液 B.稀硫酸 C.二氧化碳
(5)取5.4g铝土矿进行实验,最后得到氧化铝5.1g,则该铝土矿中铝的含量为____________(假设实验过程没有损失)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com