
【题目】某温度下,向10mL0.1 mol/L的醋醵溶液中逐滴加入等浓度的NaOH溶液,溶液中pH与pOH[pOH=-lgc (OH-)]的变化关系如图所示。则下列说法正确的是
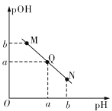
A. 两者恰好反应完全,需要NaOH溶液的体积大于10mL
B. Q点时溶液的pH=7
C. M点时溶液呈碱性,对水的电离起抑制作用
D. N点所示溶液中,c(CH3COO-)>c(CH3COOH)
【答案】D
【解析】A.两者恰好反应完全,醋酸和氢氧化钠的物质的量相同;B、常温时,中性溶液的PH才为7;C、酸碱抑制水的电离;D、
A. 醋酸和氢氧化钠的物质的量相同,两者恰好反应完全,需要NaOH溶液的体积等于10mL,故A错误;B.Q点pOH=pH,说明c(H+)═c(OH-),溶液显中性,但温度末知, Q点时溶液的pH不一定为7,故B 错误;C. M点时溶液中溶质为醋酸和醋酸钠,呈酸性,对水的电离起抑制作用,故C错误;D. N点所示溶液中,溶质为醋酸钠和过量的氢氧化钠,溶液中离子以CH3COO-为主,水解产生的醋酸分子较少,故c(CH3COO-)>c(CH3COOH),故D正确;故选D。


科目:高中化学 来源: 题型:
【题目】一种钌(Ru)基配合物光敏染料敏化太阳能电池的示意图如下。电池工作时电极上发生的反应为:
![]()
下列关于该电池的叙述正确的是

A. 电池工作时,是将化学能转化为电能
B. 电池工作时,电解质溶液中I-和I3-浓度不断减少
C. 透明导电玻璃上的电势比镀Pt导电玻璃上的电势高
D. 电解质溶液中发生反应:2Ru3++3I-=2Ru2++I3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______,写出正极的电极反应________。若构建原电池时两个电极的质量相等,当导线中通过0.05mol电子时,两个电极的质量差为________。
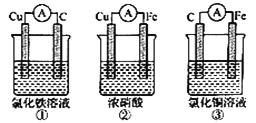
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。

①实验测得OH-定问移向B电极,则_____处电极入口通甲烷(填A或B),其电极反应式为 ___________。
②当消耗甲院的体积为33.6L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度和压强下,在2 L的密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) 。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。下列说法错误的是:
2NH3(g) 。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。下列说法错误的是:
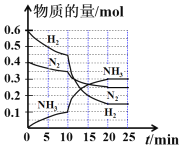
A. 0~10 min内,以NH3表示的平均反应速率为0.005 mol L-1 min-1
B. 10~20 min内,NH3浓度变化的原因可能是加入催化剂或缩小容器体积
C. 该反应在20 min时达到化学平衡状态
D. N2的平衡转化率与H2平衡转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种钌(Ru)基配合物光敏染料敏化太阳能电池的原理及电池中发生的主要反应如图所示。下列说法正确的是

A. 镀铂导电玻璃的作用是传递I-
B. 电池工作时,光能转变为电能,X为电池的正极
C. 电池的电解质溶液中I-和I3-的浓度均不断减小
D. 电解质溶液中发生反应2Ru3++3I-═2Ru2++I3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图实验装置进行有关实验,下列对结论的叙述正确的是
选项 | ①中试剂 | ②中试剂 | 结论 |
|
A | 镁条、蒸馏水 | 肥皂水 | ②中开始出现气泡,说明①中生成了氢气 | |
B | 铜片、硝酸溶液 | 蒸馏水 | ②中试管口出现红棕色气体,说明①中生成了NO2 | |
C | 二氧化锰、浓盐酸 | 淀粉KI溶液 | 该装置可以用来检验①中是否产生了氯气 | |
D | 乙醇、乙酸、浓硫酸 | 饱和NaOH溶液 | 该装置可以用来制备乙酸乙酯 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理。下列说法正确的是

A. 制取氨气时烧瓶中的固体常用CaO或CaCl2
B. 将湿润的蓝色石蕊试纸置于三颈瓶口,试纸变红,说明NH3已经集满
C. 关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内压强变化曲线如图2,则E点时喷泉最剧烈
D. 工业上,若出现液氨泄漏,喷稀盐酸比喷洒NaHCO3溶液处理效果好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表部分短周期元素信息,判断以下叙述正确的是( )

A. 氢化物的沸点为H2T<H2R B. 单质与稀盐酸反应的剧烈程度L<Q
C. M与T形成的化合物具有两性 D. L2+与R2﹣的核外电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验需要100 mL、1 mol/L的Na2CO3溶液,现通过如下操作配制:
①把称量好的固体Na2CO3放入小烧杯中,加适量蒸馏水溶解。为加快溶解可以用玻璃棒搅拌;
②把①所得溶液冷却到室温后,小心转入到容量瓶中
③继续加蒸馏水至液面至刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低点与刻度线相切;
④用少量蒸馏水洗涤玻璃棒和烧杯2~3次,每次洗涤的溶液都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞紧,充分摇匀。
(1)操作步骤正确的顺序是(填序号)。①② ⑤
(2)若没有操作④,则所配溶液的浓度会 (填“偏高”或“偏低”)。
(3)若所配溶液的密度为1.06 g/mL,则该溶液的质量分数为 。
(4)在配制100 mL、1 mol/L的Na2CO3溶液时,下列操作中的 会导致结果偏低(请用序号填写)
①用托盘天平称量时砝码放在左盘
②将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外
③定容时俯视刻度线
④定容时仰视刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com