
【题目】某铝土矿主要含Al2O3和SiO2。某课题组以此为原料回收氧化铝,设计实验流程如下:
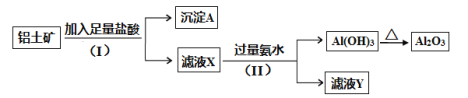
(1)步骤(I)中分离溶液和沉淀的操作名称是_____,实验中除了烧杯和玻璃棒外,还需要用到的玻璃仪器是_____。
(2)沉淀A中一定含有_________(用化学式表示),该物质属于________(填 “酸性”或“碱性”)氧化物。
(3)写出步骤(Ⅱ)中生成Al(OH)3的离子方程式___________________。
(4)实验室里用Na[Al(OH)4]溶液制取Al(OH)3最好选用__________(填序号)。
A.NaOH溶液 B.稀硫酸 C.二氧化碳
(5)取5.4g铝土矿进行实验,最后得到氧化铝5.1g,则该铝土矿中铝的含量为____________(假设实验过程没有损失)。
【答案】过滤 漏斗 SiO2 酸性 Al3+ +3NH3·H2O=Al(OH)3↓+3NH4+ C 50%
【解析】
根据题给流程和信息知铝土矿加入足量盐酸反应,发生反应:Al2O3+6HCl=2AlCl3+3H2O,过滤,沉淀A为SiO2,滤液X为氯化铝溶液;向滤液X中加入过量氨水,发生反应:AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl,过滤,滤液Y为氯化铵和氨水的混合液,沉淀氢氧化铝受热分解生成氧化铝,据此答题。
(1)步骤(I)中分离溶液和沉淀的操作名称是过滤,过滤要用到的玻璃仪器除烧杯和玻璃棒外,还需要漏斗,故答案为:过滤,漏斗。
(2)沉淀A中一定含有SiO2,该物质属于酸性氧化物,故答案为:SiO2,酸性。
(3)氯化铝溶液中加入过量氨水,二者反应生成氢氧化铝和氯化铵,离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3·H2O=Al(OH)3↓+3NH4+。
(4)氢氧化铝为两性氢氧化物,能溶于强酸、强碱,为保证铝元素全部转化为氢氧化铝沉淀,实验室里用Na[Al(OH)4]溶液制取Al(OH)3最好选用二氧化碳,选C,故答案为:C。
(5)5.1g氧化铝的物质的量为:5.1g÷102g/mol=0.05mol,则n(Al)=0.1mol,m(Al)=0.1mol×27g/mol=2.7g,则该铝土矿中铝的含量为2.7g/5.4g×100%=50%,故答案为:50%。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】利用下图实验装置进行有关实验,下列对结论的叙述正确的是
选项 | ①中试剂 | ②中试剂 | 结论 |
|
A | 镁条、蒸馏水 | 肥皂水 | ②中开始出现气泡,说明①中生成了氢气 | |
B | 铜片、硝酸溶液 | 蒸馏水 | ②中试管口出现红棕色气体,说明①中生成了NO2 | |
C | 二氧化锰、浓盐酸 | 淀粉KI溶液 | 该装置可以用来检验①中是否产生了氯气 | |
D | 乙醇、乙酸、浓硫酸 | 饱和NaOH溶液 | 该装置可以用来制备乙酸乙酯 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一种一元强酸HA溶液中加入一种碱MOH,溶液呈中性,下列判断正确的是
A.加入的碱过量
B.反应后溶液中c(A-)=c(M+)
C.混合前酸与碱中溶质的物质的量相等
D.生成的盐发生水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化铝和氢氧化铝的叙述错误的是( )
A. Al(OH)3受热能分解
B. Al2O3既能溶于强酸溶液又能溶于强碱溶液
C. Al(OH)3胶体能吸附水中的悬浮物
D. Al(OH)3与过量的浓氨水反应生成NH4[Al(OH)4]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验需要100 mL、1 mol/L的Na2CO3溶液,现通过如下操作配制:
①把称量好的固体Na2CO3放入小烧杯中,加适量蒸馏水溶解。为加快溶解可以用玻璃棒搅拌;
②把①所得溶液冷却到室温后,小心转入到容量瓶中
③继续加蒸馏水至液面至刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低点与刻度线相切;
④用少量蒸馏水洗涤玻璃棒和烧杯2~3次,每次洗涤的溶液都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞紧,充分摇匀。
(1)操作步骤正确的顺序是(填序号)。①② ⑤
(2)若没有操作④,则所配溶液的浓度会 (填“偏高”或“偏低”)。
(3)若所配溶液的密度为1.06 g/mL,则该溶液的质量分数为 。
(4)在配制100 mL、1 mol/L的Na2CO3溶液时,下列操作中的 会导致结果偏低(请用序号填写)
①用托盘天平称量时砝码放在左盘
②将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外
③定容时俯视刻度线
④定容时仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素金属性、非金属性强弱判断不正确的是( )
A. 高温下2C+SiO2![]() 2CO↑+Si,说明非金属性:C>Si
2CO↑+Si,说明非金属性:C>Si
B. 碱性:KOH>Mg(OH)2,说明金属性:K>Mg
C. 氟气与氢气在暗处相遇就会爆炸,氯气与氢气混合在光照或点燃时发生爆炸,说明非金属性:F>Cl
D. 氧化性:Cu2+>Na+,说明金属性:Na>Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A. 10 g的D2O中含有的质子数与中子数分别为5NA和4NA
B. 常温下56g铁片投入足量浓H2SO4中生成1.5NA个SO2分子
C. 常温下,22gCO2和N2O混合气体中,含有的原子数目为1.5NA
D. pH=1的H3PO4溶液中,含有0.1NA个H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由Na、Mg、A1、Fe四种金属单质中的两种组成的混合物共12g,跟足量盐酸反应,产生5.6LH2(标准状况下),由此可判断混合物中必定含有
A. Na B. Fe C. Mg D. Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素或者化合物性质的比较中,正确的是![]()
![]()
A. 结构相似的分子晶体的熔沸点,与相对分子质量呈正相关,所以![]()
B. Na、Mg、Al原子最外层电子数依次增多,原子半径也依次增大
C. 在分子中,两个原子间的键长越长,键能越大
D. 一般而言,晶格能越高,离子晶体的熔点越高、硬度越大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com