
| A、Fe作正极,Zn作负极 |
| B、Fe处发生的反应为:Fe+Cu2+═Fe2++Cu |
| C、Fe作负极,Zn作正极 |
| D、Zn处发生的反应为:Zn+Cu2+═Zn2++Cu |
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L Cl2完全反应时,转移电子数一定为2NA |
| B、常温下,l LpH=l的H2SO4溶液中含有的H+的数目为0.2NA |
| C、标准状况下,2.24 L NH3中含有共价键的数目为NA |
| D、常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
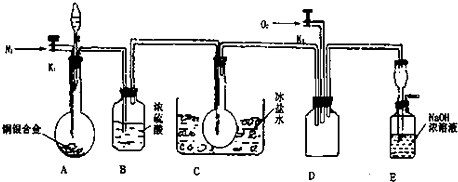
 实验室制取乙烯:C2H5OH
实验室制取乙烯:C2H5OH | 170℃ |
| 浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、60s内反应速率为v(X)=0.05 mol/(L?s),X的转化率为80% | ||
| B、其它条件不变,若初始投入2mol X和2mol Y则物质Y的转化率减小 | ||
| C、其它条件不变,若升高温度,X的体积分数增大,则该反应的△H>0 | ||
D、其它条件不变,将容器体积变为4L,Z的平衡浓度变为原来的
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com