


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、中子数为8的N原子:78N |
B、离子结构示意图: 只能表示35Cl- 只能表示35Cl- |
| C、碳酸氢钠在水溶液中的电离方程式:NaHCO3=Na++HCO3- |
| D、作为相对原子质量标准的碳原子:614C |
查看答案和解析>>
科目:高中化学 来源: 题型:
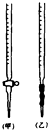 某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下:
某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通入甲烷的一极为负极 |
| B、通入氧气的一极发生还原反应 |
| C、该电池总反应为:CH4+2O2+2OH-=CO32-+3H2O |
| D、该电池在工作时,溶液中的阴离子向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe作正极,Zn作负极 |
| B、Fe处发生的反应为:Fe+Cu2+═Fe2++Cu |
| C、Fe作负极,Zn作正极 |
| D、Zn处发生的反应为:Zn+Cu2+═Zn2++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、构成原电池的正极和负极必须是两种不同的金属 |
| B、原电池是将化学能转变为电能的装置 |
| C、原电池中电子流出的一极是负极,该极被还原 |
| D、原电池放电时,电流的方向是从负极到正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子式为C3H8与C6H14的两种有机物一定互为同系物 |
| B、具有相同通式的有机物一定互为同系物 |
| C、两个相邻同系物的相对分子质量数值一定相差12 |
| D、分子组成相差一个或几个CH2原子团的化合物必定互为同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com