
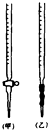
 某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下:
某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下:| 2 |
| 5 |
| 5 |
| 2 |
| c(KMnO4)V(KMnO4) |
| V(H2C2O4) |
| △c |
| △t |
| 100 |
| 25 |
| 0.02mol×90g/mol |
| 2.80g |
| 2 |
| 5 |
| 5 |
| 2 |
| c(KMnO4)V(KMnO4) |
| V(H2C2O4) |
| 0.1mol/L×2ml |
| 2ml+2ml |
| 0.05mol/L |
| 10s |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、CO2的摩尔质量为44g |
| B、标准状况下,2.24L CCl4所含的原子数为0.5NA |
| C、5.4mL4℃的H2O中有1.806×1023个分子 |
| D、50mL 1mol/L BaCl2溶液中,Ba2+和Cl-物质的量之和是0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
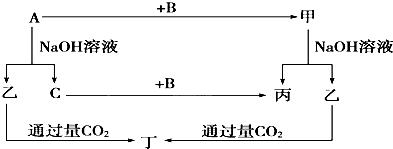
查看答案和解析>>
科目:高中化学 来源: 题型:
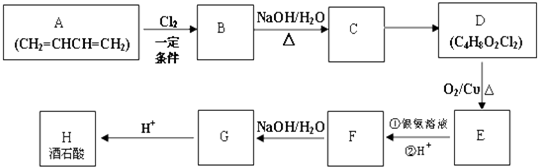

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
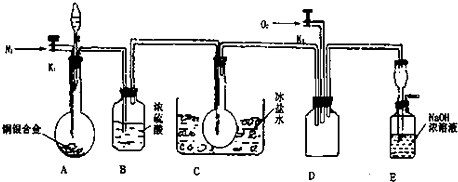
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用溴水鉴别苯、乙醇、己烯、四氯化碳 |
| B、加浓溴水,后过滤除去苯中少量苯酚 |
| C、苯、溴水、铁粉混合制成溴苯 |
| D、可用分液漏斗分离溴乙烷和甲苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com