
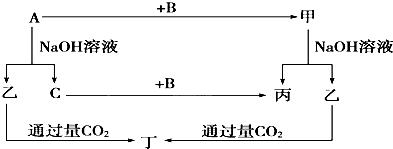
| 0.3 |
| 3 |


科目:高中化学 来源: 题型:
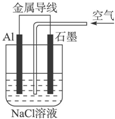
| A、铝是负极,铝片上析出无色气体 |
| B、石墨是阳极,石墨棒上析出黄绿色气体 |
| C、溶液中两电极间产生白色沉淀 |
| D、溶液中先产生白色沉淀,最后沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X、Y、Z均属于短周期元素 |
| B、离子半径X+>Y- |
| C、Y的气态氢化物可形成氢键 |
| D、X、Y、Z三种元素组成的化合物中既含有离子键又含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中子数为8的N原子:78N |
B、离子结构示意图: 只能表示35Cl- 只能表示35Cl- |
| C、碳酸氢钠在水溶液中的电离方程式:NaHCO3=Na++HCO3- |
| D、作为相对原子质量标准的碳原子:614C |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、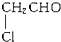 |
| B、HOCH2CH2OH |
C、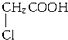 |
D、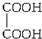 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硫的正常沸点在 25~157℃之间 |
| B、25℃贮有半满液态二氧化硫容器内的压力为5 atm |
| C、气态二氧化硫在150℃,80 atm时不能液化 |
| D、25℃和1 atm下二氧化硫是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
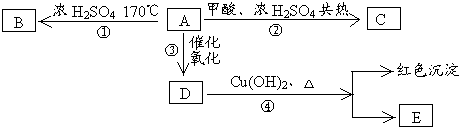
查看答案和解析>>
科目:高中化学 来源: 题型:
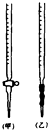 某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下:
某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、构成原电池的正极和负极必须是两种不同的金属 |
| B、原电池是将化学能转变为电能的装置 |
| C、原电池中电子流出的一极是负极,该极被还原 |
| D、原电池放电时,电流的方向是从负极到正极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com