
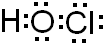 ,故答案为:
,故答案为: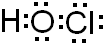 ;
;

 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
| A、酸性氧化物一定是非金属氧化物,金属氧化物一定是碱性氧化物 |
| B、氢气中氢元素的化合价为0,所以氢分子中没有化学键 |
| C、离子键只存在于离子化合物中,而共价键可能存在于离子化合物或共价化合物中 |
| D、往饱和NaCl溶液中先通CO2至饱和,再往溶液中通NH3至饱和,可析出大量NaHCO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硫的正常沸点在 25~157℃之间 |
| B、25℃贮有半满液态二氧化硫容器内的压力为5 atm |
| C、气态二氧化硫在150℃,80 atm时不能液化 |
| D、25℃和1 atm下二氧化硫是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下:
某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:
A、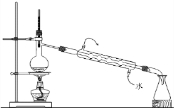 用如图装置进行蒸馏实验 用如图装置进行蒸馏实验 |
B、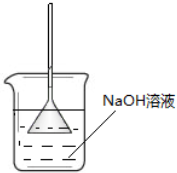 用如图装置吸收氯化氢气体 用如图装置吸收氯化氢气体 |
C、 用酒精提取溴水中的溴 用酒精提取溴水中的溴 |
D、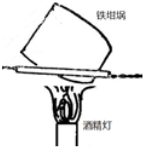 用如图装置灼烧小苏打制取少量的苏打 用如图装置灼烧小苏打制取少量的苏打 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通入甲烷的一极为负极 |
| B、通入氧气的一极发生还原反应 |
| C、该电池总反应为:CH4+2O2+2OH-=CO32-+3H2O |
| D、该电池在工作时,溶液中的阴离子向正极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com