
| A、标准状况下,22.4L Cl2完全反应时,转移电子数一定为2NA |
| B、常温下,l LpH=l的H2SO4溶液中含有的H+的数目为0.2NA |
| C、标准状况下,2.24 L NH3中含有共价键的数目为NA |
| D、常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子 |
| V |
| Vm |
| V |
| Vm |
| 2.24L |
| 22.4L/mol |
| m |
| M |
| 23g |
| 46g/mol |


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
| 元素 | 相关结构和性质 |
| A | 其单质的一种晶体虽不是金属晶体,但是电的良导体,且难熔、质软并有润滑性,可用作原子核反应堆的慢化剂、火箭发动机喷管和电极材料等. |
| B | 其单质既能与强酸溶液反应,又能与强碱溶液反应,其简单离子在第三周期单核离子中半径最小. |
| C | 是蛋白质的组成元素之一,原子核外有3种不同能量的电子,且未成对电子数最多. |
| D | 原子核外最外层电子排布式为nsnnp2n+1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
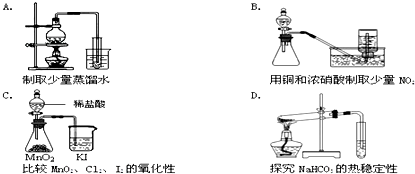
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe作正极,Zn作负极 |
| B、Fe处发生的反应为:Fe+Cu2+═Fe2++Cu |
| C、Fe作负极,Zn作正极 |
| D、Zn处发生的反应为:Zn+Cu2+═Zn2++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为
| ||
| B、1 mol甲基(-CH3)所含的电子总数为10NA | ||
| C、7 g CnH2n中含有的氢原子数目为NA | ||
| D、1mol金刚石晶体中,平均含有碳碳单键键数为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯和聚乙烯都能发生加成反应 |
| B、淀粉和纤维素的分子式相同,互为同分异构体 |
| C、粮食酿酒的过程涉及到了水解反应、氧化还原反应等复杂变化 |
| D、向蛋白质溶液中分别滴加饱和NaCl 溶液和CuSO4 溶液,蛋白质均发生变性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com