
| ||
| ||


科目:高中化学 来源: 题型:
| A、物质发生化学反应都伴随着能量变化 |
| B、伴有能量变化的物质变化都是化学变化 |
| C、在一个确定的化学反应过程中,反应物的总能量总是高于生成物的总能量 |
| D、凡是经过加热而发生的化学反应都是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
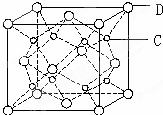 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子序数为29;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子序数为29;D与E同周期,价电子数为2.则:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
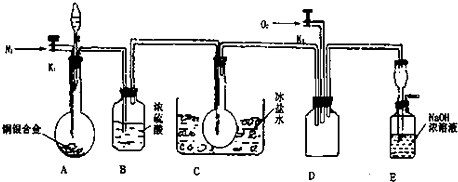
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L Cl2完全反应时,转移电子数一定为2NA |
| B、常温下,l LpH=l的H2SO4溶液中含有的H+的数目为0.2NA |
| C、标准状况下,2.24 L NH3中含有共价键的数目为NA |
| D、常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
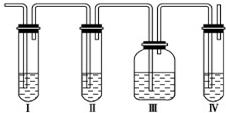 实验室制取乙烯:C2H5OH
实验室制取乙烯:C2H5OH | 170℃ |
| 浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
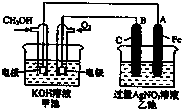 目前工业上利用CO2来生产燃料甲醇,可将CO2变废为宝.
目前工业上利用CO2来生产燃料甲醇,可将CO2变废为宝. 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com