
(14分)(1)用质量分数为36.5%的浓盐酸(密度为1.16g/cm3)配制成1mol/L的稀盐酸。现实验室仅需要这种盐酸220mL。试回答下列问题:
①配制稀盐酸时,应选用容量为______mL的容量瓶;
②经计算需要______mL浓盐酸,在量取时宜选用下列量筒中的______。
A.5ml B.10mL C.25mL D.50mL
(2)若某药品质量约为32.0 g,用托盘天平准确称其质量,若用↓表示在右盘放上砝码,用↑表示将砝码取下,在下列表格的空格内,用↓和↑表示相应砝码的放上或取下。
50 g | 20 g | 20 g | 10 g | 5 g |
|
|
|
|
|
(3)在配制一定物质的量浓度的溶液时,用“偏高、偏低、无影响”表示下列操作对所配溶液浓度的影响。
①用量筒取液态溶质,读数时,俯视量筒,所配制溶液的浓度 。
②将量取液态溶质的量筒用水洗涤,洗涤液倒入容量瓶,所配制溶液的浓度 。
③定容摇匀后,有少量溶液外流,对所配制溶液的浓度 。
(1)①250 ② 21.6 C (2)
50 g | 20 g | 20 g | 10 g | 5 g |
↓↑ | ↓ | ↓↑ | ↓ | ↓↑ |
(3)①偏低; ②偏高; ③无影响。
【解析】
试题分析:(1)①实验室需要1mol/L的稀盐酸220mL,由于容量瓶与该体积最接近的是250ml的容量瓶,②在溶液稀释前后溶质的物质的量不变,质量分数为36.5%的浓盐酸(密度为1.16g/cm3)的物质的量浓度是C=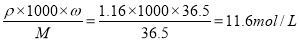 ,11.6mol/L×V=1mol/L×250ml,解得V=21.6ml,在量取液体时,量筒的规格与量取的液体的体积越接近,误差就越小,所以应该选择25mL的量筒,选项是C。(2)称量物质的质量时,使用砝码,应该先取用大的,再取用小的,现在称量的要某药品质量约为32.0 g,所以相应砝码的放上或取下的顺序是:
,11.6mol/L×V=1mol/L×250ml,解得V=21.6ml,在量取液体时,量筒的规格与量取的液体的体积越接近,误差就越小,所以应该选择25mL的量筒,选项是C。(2)称量物质的质量时,使用砝码,应该先取用大的,再取用小的,现在称量的要某药品质量约为32.0 g,所以相应砝码的放上或取下的顺序是:
50 g | 20 g | 20 g | 10 g | 5 g |
↓↑ | ↓ | ↓↑ | ↓ | ↓↑ |
(3)①用量筒取液态溶质,读数时,俯视量筒,则溶质的物质的量偏小,所配制溶液的浓度偏低;②将量取液态溶质的量筒用水洗涤,洗涤液倒入容量瓶,则容量瓶中溶质的物质的量偏大,所配制溶液的浓度偏高;③定容摇匀后,由于溶液有均一性,所以即使有少量溶液外流,对所配制溶液的浓度也不能产生任何影响。
考点:考查物质的量溶液的配制的操作步骤、仪器的选择和使用、误差分析及液态溶质的体积的计算。


科目:高中化学 来源:2015届浙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
为探究溴乙烷与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三名同学分别设计如下三个实验方案:
甲:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
乙:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成, 则可证明发生了消去反应。
丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则证明发生了消去反应。
则有关上述实验方案叙述( )
A.甲正确 B.乙正确 C.丙正确 D.上述实验方案都不正确
查看答案和解析>>
科目:高中化学 来源:2015届浙江省“温州八校”高三返校联考化学试卷(解析版) 题型:选择题
“暖冰”是韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的。某老师在课堂上做了一个如右图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN 的FeCl2溶液,则溶液呈血红色。则下列说法中不正确的是
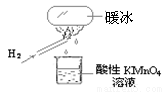
A.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
D.该条件下H2燃烧的产物中可能含有一定量的H2O2
查看答案和解析>>
科目:高中化学 来源:2015届河南长葛第三实验高中高二下学期第一次考试化学试卷(解析版) 题型:选择题
现有三组混合液:①乙酸乙酯和乙酸钠溶液 ②乙醇和丁醇 ⑧溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源:2015届河南长葛第三实验高中高二下学期第一次考试化学试卷(解析版) 题型:选择题
下列各组物质中,相互间一定互为同系物的是( )
A.C4H10和C20H42 B.邻二甲苯和对二甲苯
C.C4H8和C3H6 D.一溴乙烷和1,2—二溴乙烷
查看答案和解析>>
科目:高中化学 来源:2015届河南省高三上学期第一次测试化学试卷(解析版) 题型:选择题
下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是
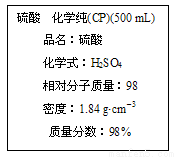
A.该硫酸的物质的量浓度为9.2 mol·L-1
B.1 mol Zn与足量的该硫酸反应产生2 g氢气
C.配制200 mL 4.6 mol·L-1的稀硫酸需取该硫酸50 mL
D.等质量的水与该硫酸混合所得溶液的物质的量浓度大于9.2 mol/L.
查看答案和解析>>
科目:高中化学 来源:2015届河南省顶级名校高三入学定位考试化学试卷(解析版) 题型:推断题
(11分)A是自然界存在最广泛的ⅡA族元素,常以化合物F存在。从单质A起始发生的一系列化学反应可由下图表示:
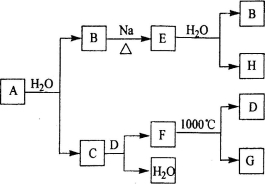
请回答下列问题:
(1)A与水反应的化学方程式为____________,E与水反应的化学方程式为______ _ ______;
(2)F的化学式为_____________,G和D的电子式分别为____________和______________;
(3)D与H反应可能生成的盐有_______ ______ (填化学式);
(4)如何由F制备A : 。
查看答案和解析>>
科目:高中化学 来源:2015届河南省偃师市高三上学期第一次月考化学试卷(解析版) 题型:填空题
(13分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
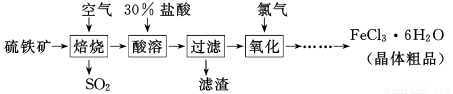
回答下列问题:
Ⅰ、(1)在一定条件下,SO2转化为SO3的化学反应为2SO2(g)+O2(g)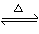 2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。
2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(3)通氯气氧化时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为 (写化学式)。
Ⅱ、 已知: CuCl2溶液中含有少量杂质FeCl2,为制备纯净的CuCl2·2H2O晶体,拟定实验步骤如图所示:
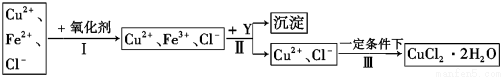
请回答下列问题:
(4)步骤Ⅰ中,将Fe2+转化为Fe3+最好选用下列氧化剂中的 (填字母)。
A.K2Cr2O7 B.NaClO C.H2O2
该反应的离子方程式为 。
(5)在步骤Ⅱ中,加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可以是下列物质中的 (填字母)。
A.NaOH B.Cu C.Cu2(OH)2CO3
(6)步骤Ⅲ应控制的实验条件是 。
查看答案和解析>>
科目:高中化学 来源:2015届河北省邯郸市高三第一次调研考试化学试卷(解析版) 题型:选择题
某固体仅由一种元素组成,其密度为5 g/cm3。用X射线研究该固体的结果表明:在棱长为1×10-7 cm的立方体中含有20个原子,则此元素的相对原子质量最接近( )
A.32 B.65 C.120 D.150
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com