
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)CO(g)+3H2(g) H1=+216.4kJ/mol
b. CO(g)+H2O(g)CO2(g)+H2(g) H2=–41.2kJ/mol
则反应CH4(g)+2H2O(g)CO2(g)+4H2(g) H= _____________。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
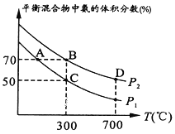
①恒压时,反应一定达到平衡状态的标志是_____________(填序号)
A.![]() 和
和![]() 的转化率相等 B.反应体系密度保持不变
的转化率相等 B.反应体系密度保持不变
C.相同时间内,断开H-H键的数目和生成N-H键的数目相同
D.容器内气体浓度c(N2):c(H2):c (NH3)=1:3:2
②P1_____P2 (填“>” “<”“=”或“不确定”,下同);反应的平衡常数:C点______B点_______D点。
③C点![]() 的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________υ(B)。
的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________υ(B)。
Ⅱ.用间接电化学法去除烟气中NO的原理如下图所示。
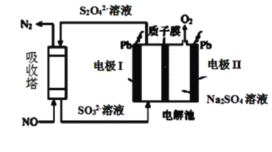
(3)已知阴极室溶液呈酸性,则阴极的电极反应式为_____________。反应过程中通过质子交换膜(ab)的![]() 为2mol时,吸收柱中生成的气体在标准状况下的体积为_____________L。
为2mol时,吸收柱中生成的气体在标准状况下的体积为_____________L。
【答案】+175.2kJ/mol B < = > 66.7% < 2SO![]() +4H++2e-=S2O
+4H++2e-=S2O![]() +2H2O 11.2
+2H2O 11.2
【解析】
利用盖斯定律求反应热;达到平衡时,正、逆反应速率相等,各物质的浓度不变,气体的总物质的量不变,以此判断;增大压强,平衡正向移动,平衡混合气体中氨气的百分含量增大;升高温度,平衡逆向移动,平衡常数减小;起始时投入氮气和氢气分别为1mol、3mol,反应的方程式为N2(g)+3H2(g)2NH3(g),C点氨气的含量为50%,结合方程式计算;压强越大、温度越高,反应速率越快;根据图示可知,阴极通入的亚硫酸根发生得电子的还原反应生成S2O![]() ,结合溶液为酸性书写阴极反应式;写出电解池的总反应,根据通过的氢离子物质的量可知转移电子的物质的量,吸收柱中生成的气体为氮气,然后利用电子守恒计算氮气的物质的量,最后根据V=nVm计算标况下体积。
,结合溶液为酸性书写阴极反应式;写出电解池的总反应,根据通过的氢离子物质的量可知转移电子的物质的量,吸收柱中生成的气体为氮气,然后利用电子守恒计算氮气的物质的量,最后根据V=nVm计算标况下体积。
I.(1)已知a.CH4(g)+H2O(g)CO(g)+3H2(g) H1=+216.4kJ/mol
b.CO(g)+H2O(g)CO2(g)+H2(g) H2=–41.2kJ/mol
将a+b,可得CH4(g)+2H2O(g)CO2(g)+4H2(g) H= (+216.4-41.2)kJ/mol=+175.2kJ/mol;
(2)①A.N2和H2的起始物料比为1:3,且按照1:3反应,则无论是否达到平衡状态,转化率都相等,N2和H2转化率相等不能用于判断是否达到平衡状态,故A错误;
B.气体的总质量不变,由于该反应的正反应是气体体积减小的反应,恒压条件下,当反应体系密度保持不变时,说明体积不变,则达到平衡状态,故B正确;
C.相同时间内,3H2+N2![]() 2NH3,假设断开3molH-H键的数目为3NA,和生成6molN-H键的数目为6NA,数目不相等,且代表相同方向的速率,不能代表化学平衡,故C错误;
2NH3,假设断开3molH-H键的数目为3NA,和生成6molN-H键的数目为6NA,数目不相等,且代表相同方向的速率,不能代表化学平衡,故C错误;
D.达平衡时各物质的浓度保持不变,但不一定等于化学计量数之比,c(N2):c(H2):c (NH3)=1:3:2,不能确定反应是否达到平衡状态,D错误;
故正确的是B;
②由于该反应的正反应是气体体积减小的反应,增大压强,平衡正向移动,平衡混合气体中氨气的百分含量增大,由图象可知P1<P2,该反应的正反应是放热反应,升高温度,平衡逆向移动,平衡常数减小,则反应平衡常数:B点>D点,B和C在相同的温度下,平衡常数相等,B点=C点,C点=B点>D点;
③起始时投入氮气和氢气分别为1mol、3mol,反应的方程式为N2(g)+3H2(g)2NH3(g),C点氨气的含量为50%,设转化N2物质的量为xmol,则 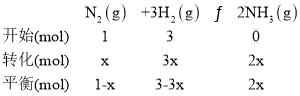
则![]() ×100%=50%,解得x=
×100%=50%,解得x=![]() ,则C点H2的转化率为
,则C点H2的转化率为![]() ×100%=66.7%,B点的压强、温度都比A点高,压强越大、温度越高,反应速率越大,所以υ(A)<υ(B);
×100%=66.7%,B点的压强、温度都比A点高,压强越大、温度越高,反应速率越大,所以υ(A)<υ(B);
II. (3) 根据图示可知,阴极通入的亚硫酸根-发生得电子的还原反应生成S2O![]() ,则阴极反应式为:2SO
,则阴极反应式为:2SO![]() +4H++2e-=S2O
+4H++2e-=S2O![]() +2H2O;反应过程中通过质子交换膜(ab)的H+为2mol时,吸收柱中生成的气体在标准状况下的体积为电解池的阳极水电离出的氢氧根离子放电生成氧气,发生反应为:
+2H2O;反应过程中通过质子交换膜(ab)的H+为2mol时,吸收柱中生成的气体在标准状况下的体积为电解池的阳极水电离出的氢氧根离子放电生成氧气,发生反应为:![]() +4H+
+4H+![]() 2S2O
2S2O![]() +2H2O+O2↑,即转移4mol电子时有4mol氢离子通过质子交换膜,则反应过程中通过质子交换膜(ab)的H+为2mol时,转移电子的物质的量为2mol,生成1mol S2O
+2H2O+O2↑,即转移4mol电子时有4mol氢离子通过质子交换膜,则反应过程中通过质子交换膜(ab)的H+为2mol时,转移电子的物质的量为2mol,生成1mol S2O![]() ,图示NO吸收柱中S2O
,图示NO吸收柱中S2O![]() 失去电子被氧化成SO
失去电子被氧化成SO![]() ,NO得到电子被还原成N2,根据得失电子守恒可知,吸收柱中生成N2的物质的量为:n(N2)=
,NO得到电子被还原成N2,根据得失电子守恒可知,吸收柱中生成N2的物质的量为:n(N2)=![]() =0.5mol,标况下0.5mol氮气的体积为:22.4L/mol×0.5mol=11.2L。
=0.5mol,标况下0.5mol氮气的体积为:22.4L/mol×0.5mol=11.2L。


科目:高中化学 来源: 题型:
【题目】300mLAl2(SO4)3溶液中,含有Al3+为1.62 克,在该溶液中加入0.1mol/LBa(OH)2溶夜300ml,反应后溶液中SO42-的物质的量浓度约为
A. 0.4 mol/L B. 0.3 mol/L C. 0.1 mol/L D. 0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
A. 电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B. 电池充电过程中,阴极附近溶液的酸性增强
C. 电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2
D. 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将等径圆球在二维空间里进行排列,可形成密置层和非密置层,在图1所示的半径相等的圆球的排列中,A属于________层,配位数是________;B属于________层,配位数是________。
(2)将非密置层一层一层地在三维空间里堆积,得到如图2所示的一种金属晶体的晶胞,它被称为简单立方堆积,在这种晶体中,金属原子的配位数是________,平均每个晶胞所占有的原子数目是________。

(3)有资料表明,只有钋的晶体中的原子具有如图2所示的堆积方式,钋位于元素周期表的第________周期第__________族,元素符号是________,最外电子层的电子排布式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修5:有机化学基础)(15分)
有机化合物G是合成维生素类药物的中间体,其结构简式如图所示

G的合成路线如下图所示:

其中A~F分别代表一种有机化合物,合成路线中部分产物及反应条件已略去
已知:
请回答下列问题:
(1)G的分子式是 ,G中官能团的名称是 ;
(2)第②步反应的化学方程式是 ;
(3)B的名称(系统命名)是 ;
(4)第②~⑥步反应中属于取代反应的有 (填步骤编号);
(5)第④步反应的化学方程式是 ;
(6)写出同时满足下列条件的E的所有同分异构体的结构简式 。
①只含一种官能团;②链状结构且无-O-O-;③核磁共振氢谱只有2种峰。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A由C、H、O三种元素组成,相对分子质量为90。将4.5 g A完全燃烧的产物依次通过足量的浓硫酸和碱石灰,分别增重2.7 g和6.6 g。A能与NaHCO3溶液产生CO2,且两分子A之间脱水可生成六元环状化合物。有关A的说法正确的是
A. 有机物A的分子式为C3H8O3
B. 0.1 mol A与足量Na反应生成2.24 L H2
C. A催化氧化的产物不能发生银镜反应
D. A能在一定条件下发生缩聚反应生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释有关事实的方程式不正确的是
A.铝热法炼铁:Fe2O3+ 2Al![]() Al2O3+ 2Fe
Al2O3+ 2Fe
B.工业上用NH3制备NO:4NH3+ 5O2![]() 4NO十6H2O
4NO十6H2O
C.向受酸雨影响的湖泊中喷洒CaCO3粉末:CO![]() +2H+=H2O+CO2↑
+2H+=H2O+CO2↑
D.淀粉酿酒:(C6H10O5)n+nH2O![]() n C6H12O6,C6H12O6
n C6H12O6,C6H12O6![]() 2C2H5OH+2CO2
2C2H5OH+2CO2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学配制一定物质的量浓度的NaOH溶液时,造成所配制溶液浓度偏高的原因是( )
A. 转移时容量瓶未干燥
B. 定容时俯视刻度线
C. 没有洗涤烧杯和玻璃棒
D. 用带游码的托盘天平称2.4 g NaOH时误用了“左码右物”方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com