
【题目】CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为﹣24.2℃,20℃时在水中的溶解度为400mL,易溶于乙醇和丙醇等有机溶剂. Ⅰ.实验室制取CH3Cl的原理是CH3OH+HCl(浓) ![]() CH3Cl+H2O.具体步骤如下:
CH3Cl+H2O.具体步骤如下:
①干燥ZnCl2晶体;
②称取24g研细的无水ZnCl2和量取20mL浓盐酸放入圆底烧瓶,同时量取一定量的甲醇放入分液漏斗中;
③将分液漏斗里的甲醇逐滴滴入烧瓶中并加热,待ZnCl2完全溶解后有CH3Cl气体逸出,可用排水法收集.请回答:
(1)实验室干燥ZnCl2晶体制得无水ZnCl2的方法是 .
(2)反应过程中滴入烧瓶中甲醇的体积比盐酸少(甲醇与浓盐酸的物质的量浓度接近)其理由是 .
(3)实验室为何用排水法收集CH3Cl? .
(4)Ⅱ.据某资料记载,CH4分子中的一个H原子被Cl原子取代后,其稳定性受到影响,可被强氧化剂酸性高锰酸钾氧化.现有四只洗气瓶;分别盛有以下试剂:A.1.5%KMnO4(H+)溶液;B.蒸馏水;C.5%Na2SO3溶液;D.98%H2SO4 . ①为证实这一理论的可靠性,请从上面选择最恰当的洗气瓶,将a装置生成的气体依次通过洗气瓶(填洗气瓶编号),如果观察到则证实上述资料的正确性.
②写出洗气瓶中发生反应的离子方程式(C元素的氧化产物为CO2):
③如果CH3Cl是大气的污染物,上述洗气瓶之后还应接一只盛的洗气瓶.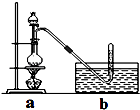
【答案】
(1)在干燥的HCl气氛中加热
(2)增大盐酸的量以提高甲醇的转化率
(3)CH3Cl不易溶于水,用排水法可除去HCl、CH3OH等杂质气体
(4)BAC; A紫色褪去;10CH3Cl+14MnO4﹣+42H+=14Mn2++10CO2↑+5Cl2↑+36H2O、SO32﹣+Cl2+H2O=SO42﹣+2Cl﹣+H+;乙醇
【解析】解:Ⅰ.(1)在加热ZnCl2晶体时可选择通HCl气体抑制其水解,所以答案是:在干燥的HCl气氛中加热;(2)为了提高甲醇的利用率,可以适当增加盐酸的量,所以答案是:增大盐酸的量以提高甲醇的转化率;(3)因CH3Cl中混有易溶于水的杂质气体,用排水法可以即除杂又可收集,所以答案是:CH3Cl不易溶于水,用排水法可除去HCl、CH3OH等杂质气体;
Ⅱ.①如果CH3Cl能被强氧化剂酸性高锰酸钾氧化,可选择先通过盛有水的洗气瓶除去可能混合有的HCl和甲醇,再通过盛有的酸性高锰酸钾洗气瓶,溶液的紫色会褐去,最后通过盛Na2SO3的洗气瓶吸收生成的氯气防污染,所以答案是:BAC;A紫色褪去;②酸性高锰酸钾氧化CH3Cl会生成CO2和Cl2,同时自身被还原成Mn2+,发生反应的离子方程式为10CH3Cl+14MnO4﹣+42H+=14Mn2++10CO2↑+5Cl2↑+36H2O,生成的氯气经过Na2SO3的洗气瓶会氧化Na2SO3为Na2SO4,发生反应的离子方程式为SO32﹣+Cl2+H2O=SO42﹣+2Cl﹣+H+,所以答案是:10CH3Cl+14MnO4﹣+42H+=14Mn2++10CO2↑+5Cl2↑+36H2O、SO32﹣+Cl2+H2O=SO42﹣+2Cl﹣+H+;③CH3Cl易溶于乙醇和丙醇等有机溶剂,可选择酒精吸收CH3Cl的尾气,所以答案是:乙醇.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】观察如图所示装置,在通电一段时间后,铁电极的质量增加了5.4g. 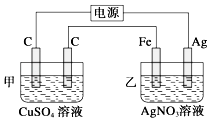
(1)经分析知,甲池是(填“原电池”或“电解池”);乙池中,银电极为极(填“阳极”或“阴极”或“正极”或“负极”).
(2)乙池中银电极的电极方程式为 , 根据题目所示数据,电路中转移了mol 电子.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物具有不同程度的毒性,会破坏人体的中枢神经,长期吸入会引起脑性麻痹,手脚萎缩等,大量吸入时会引发中枢神经麻痹,记忆丧失,四肢瘫痪,甚至死亡等后果。构成电池方法既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,发生反应6NO2+8NH3= 7N2+12H2O,装置如图所示。下列关于该电池的说法正确的是 ( )
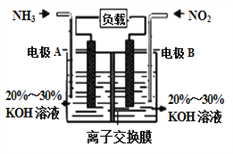
A. 电子从右侧电极经过负载后流向左侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为2NH3-6e-=N2+6H+
D. 当有4.48LNO2被处理时,转移电子物质的量为0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从植物中提取的天然化合物adamascone,可用于制作“香水”,其结构为: 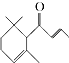 ,有关该化合物的下列说法不正确的是( )
,有关该化合物的下列说法不正确的是( )
A.分子式为C13H20O
B.该化合物可发生聚合反应
C.1 mol该化合物完全燃烧消耗19 mol O2
D.与溴的CCl4溶液反应生成的产物经水解、稀硝酸酸化后可用AgNO3溶液检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三效催化剂是最为常见的汽车尾气催化剂,其催化剂表面物质转化的关系如图所示,下列说法正确的是
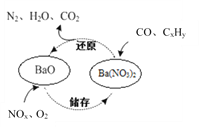
A. 在转化过程中,氮元素均被还原
B. 依据图示判断催化剂不参与储存和还原过程
C. 还原过程中生成0.1mol N2,转移电子数为0.5 mol
D. 三效催化剂能有效实现汽车尾气中CO、CxHy、NOx三种成分的净化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识回答:
(1)近年来,我国高铁迅猛发展,为人们的出行带来便利.人们利用如下反应焊接铁轨: 8Al+3Fe3O4 ![]() 4Al2O3+9Fe.该反应是(填“放热”或“吸热”)反应,反应中的还原剂是(填化学式).
4Al2O3+9Fe.该反应是(填“放热”或“吸热”)反应,反应中的还原剂是(填化学式).
(2)钠元素有NaCl、Na2O2、NaHCO3、Na2SiO3等多种重要的化合物.请根据题意选择钠的化合物的化学式填空:其中常用来作为潜水艇和呼吸面具中氧气来源的淡黄色固体是 , 常用来烘制糕点,也可用作抗酸药的是 .
(3)向FeCl2溶液中通入Cl2 , 反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl﹣ . 向所得溶液中滴加KSCN溶液,溶液变成色,我们可以利用这一现象检验Fe3+的存在.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L 恒容密闭容器中,发生反应:X(g)+Y(g)═2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表:下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率ν(Z)=2.0×10﹣5 mol/(Lmin)
B.4min时,ν(逆)>ν(正)
C.该温度下,此反应的平衡常数K=1.44
D.7min时,反应还未达到平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com