
【题目】氮氧化物具有不同程度的毒性,会破坏人体的中枢神经,长期吸入会引起脑性麻痹,手脚萎缩等,大量吸入时会引发中枢神经麻痹,记忆丧失,四肢瘫痪,甚至死亡等后果。构成电池方法既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,发生反应6NO2+8NH3= 7N2+12H2O,装置如图所示。下列关于该电池的说法正确的是 ( )
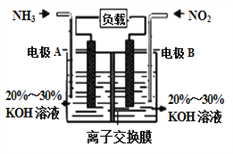
A. 电子从右侧电极经过负载后流向左侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为2NH3-6e-=N2+6H+
D. 当有4.48LNO2被处理时,转移电子物质的量为0.8mol
【答案】B
【解析】由反应6NO2+8NH3= 7N2+12H2O 可以知道,反应中NO2为氧化剂, NH3为还原剂,则A为负极,B为正极,负极发生氧化反应,正极发生还原反应,结合电解质溶液呈碱性解答该题。
由反应6NO2+8NH3= 7N2+12H2O 可以知道,反应中NO2为氧化剂, NH3为还原剂,则A为负极,B为正极;电子由负极经导线流向正极,A错误;原电池工作时,阴离子向负极移动,为使电池持续放电,离子交换膜需选用阴离子交换膜,防止二氧化氮反应生成硝酸盐和亚硝酸盐,导致原电池不能正常工作,B正确;电解质溶液呈碱性,则负极电极方程式为:2NH3-6e-+6OH-=N2+3H2O,C错误;没有给出气体所处的外界条件是否为标况下,无法利用气体摩尔体积进行计算,D错误;正确选项B。


科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol·L-1的盐酸滴 0.1000mol·L-1Na2CO3溶液25.00mL。用pH传感器测得混合溶液的pH变化曲线如图,下列说法正确的是
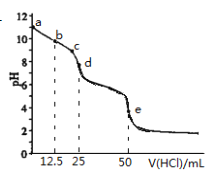
A. c→d点发生的主要离子反应:HCO3-+H+=H2O+CO2
B. 在b点时,c(CO32-)>c(HCO3-)>c(OH-)
C. 在d点时, c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D. 在e点时, c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图是从元素周期表中截取下来的,甲、乙、丙为短周期主族元素,下列说法中正确的是( )
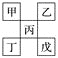
A. 丁一定是金属元素,其金属性比丙强
B. 丙的最高价氧化物水化物显强酸性
C. 乙的氢化物是以分子形式存在,且分子间存在氢键
D. 戊的原子序数一定是甲的5倍,且原子半径比甲大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关卤族元素的说法中,正确的是( )
A.酸性:HFO4>HClO4
B.最外层电子数:Br>I
C.密度:Cl2>Br2
D.热稳定性:HBr>HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用新技术减少氮氧化物、SO2等物质的排放,可促进社会主义生态文明建设。
(1)采用“联合脱硫脱氮技术” 处理烟气(含CO2、SO2、NO)可获得含CaCO3、CaSO4、Ca(NO2)2的副产品,工业流程如图所示。
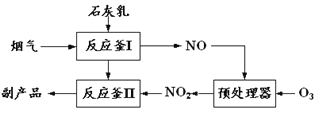
①反应釜I采用“气—液逆流”接触吸收法(如图),其优点是_____。
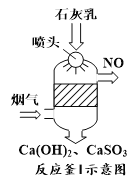
②反应釜II中CaSO3转化为CaSO4的化学反应方程式为_____。
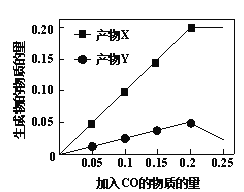
(2)为研究“CO还原SO2”的新技术,在反应器中加入0.10 mol SO2,改变加入CO的物质的量,反应后体系中产物随CO的变化如图所示。其中产物Y的化学式是____。
(3)O2/CO2燃烧技术是指化石燃料在O2和CO2的混合气体中燃烧而不是在空气中燃烧,通过该燃烧技术可收集到高纯度的CO2。
①与在空气中燃烧相比,利用O2/CO2燃烧技术,烟气中NOx的排放量明显降低,其主要原因是_____。
②利用太阳能可实现反应:2CO2(g)=2CO(g)+O2(g),该反应能自发进行的原因是______。
③700℃时,以Ni-MgO/γ-Al2O3作催化剂,向2 L密闭容器中通入CO2和CH4各3 mol,发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),反应达平衡时测得 CO的体积分数为40%,CO2的平衡转化率为_____。
2CO(g)+2H2(g),反应达平衡时测得 CO的体积分数为40%,CO2的平衡转化率为_____。
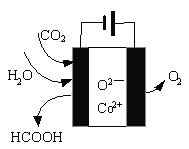
④CO2在新型钴基电催化剂作用下可转化为清洁燃料—甲酸。其工作原理如图所示,写出生成甲酸的电极反应式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法不利于环境保护的是
A. 为减少温室气体排放,应减少燃煤,大力发展新能源,如核能、风能、太阳能
B. 用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
C. 为节约垃圾处理的费用,大量采用垃圾的填埋
D. 在屋顶安装太阳能热水器为居民提供生活用热水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为﹣24.2℃,20℃时在水中的溶解度为400mL,易溶于乙醇和丙醇等有机溶剂. Ⅰ.实验室制取CH3Cl的原理是CH3OH+HCl(浓) ![]() CH3Cl+H2O.具体步骤如下:
CH3Cl+H2O.具体步骤如下:
①干燥ZnCl2晶体;
②称取24g研细的无水ZnCl2和量取20mL浓盐酸放入圆底烧瓶,同时量取一定量的甲醇放入分液漏斗中;
③将分液漏斗里的甲醇逐滴滴入烧瓶中并加热,待ZnCl2完全溶解后有CH3Cl气体逸出,可用排水法收集.请回答:
(1)实验室干燥ZnCl2晶体制得无水ZnCl2的方法是 .
(2)反应过程中滴入烧瓶中甲醇的体积比盐酸少(甲醇与浓盐酸的物质的量浓度接近)其理由是 .
(3)实验室为何用排水法收集CH3Cl? .
(4)Ⅱ.据某资料记载,CH4分子中的一个H原子被Cl原子取代后,其稳定性受到影响,可被强氧化剂酸性高锰酸钾氧化.现有四只洗气瓶;分别盛有以下试剂:A.1.5%KMnO4(H+)溶液;B.蒸馏水;C.5%Na2SO3溶液;D.98%H2SO4 . ①为证实这一理论的可靠性,请从上面选择最恰当的洗气瓶,将a装置生成的气体依次通过洗气瓶(填洗气瓶编号),如果观察到则证实上述资料的正确性.
②写出洗气瓶中发生反应的离子方程式(C元素的氧化产物为CO2):
③如果CH3Cl是大气的污染物,上述洗气瓶之后还应接一只盛的洗气瓶.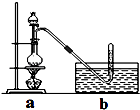
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E5种微粒,它们可能是原子或离子,并且组成它们的元素的原子序数都小于18。A微粒的最外层电子数比次外层多5个;金属原子B的原子核内质子数比前一周期的同族元素多8个,其单质不能从CuSO4溶液中置换出Cu;C元素有3种同位素:C1、C2、C3,C1的质量数分别为C2、C3的![]() 和
和![]() ;D元素的气态氢化物溶于水后显碱性;E是由两种不同元素组成的带负电荷的微粒,它共有2个原子核10个电子,E极易与C+结合成中性微粒。
;D元素的气态氢化物溶于水后显碱性;E是由两种不同元素组成的带负电荷的微粒,它共有2个原子核10个电子,E极易与C+结合成中性微粒。
(1)写出五种微粒的表示符号:A________、B________、C________、D________、E________。
(2)写出C的同位素名称:C1________、C2________、C3________。
(3)C和D形成的10个电子的分子的化学式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com