
【题目】门捷列夫的突出贡献是( )
A. 提出原子学说 B. 发现元素周期律 C. 提出分子学说 D. 发现氧气
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某有机合成中间体的结构简式如右图所示。下列关丁该有机物的叙述正确的是
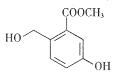
A. 分子式为C9H8O4
B. 在一定条件下可与HCHO发生缩聚反应
C. 在浓硫酸作用下可发生消去反应
D. 1 mol该物质最多能与3mol Br2发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物具有不同程度的毒性,会破坏人体的中枢神经,长期吸入会引起脑性麻痹,手脚萎缩等,大量吸入时会引发中枢神经麻痹,记忆丧失,四肢瘫痪,甚至死亡等后果。构成电池方法既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,发生反应6NO2+8NH3= 7N2+12H2O,装置如图所示。下列关于该电池的说法正确的是 ( )
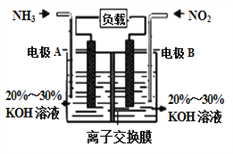
A. 电子从右侧电极经过负载后流向左侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为2NH3-6e-=N2+6H+
D. 当有4.48LNO2被处理时,转移电子物质的量为0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三效催化剂是最为常见的汽车尾气催化剂,其催化剂表面物质转化的关系如图所示,下列说法正确的是
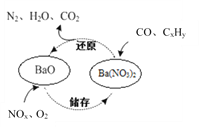
A. 在转化过程中,氮元素均被还原
B. 依据图示判断催化剂不参与储存和还原过程
C. 还原过程中生成0.1mol N2,转移电子数为0.5 mol
D. 三效催化剂能有效实现汽车尾气中CO、CxHy、NOx三种成分的净化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识回答:
(1)近年来,我国高铁迅猛发展,为人们的出行带来便利.人们利用如下反应焊接铁轨: 8Al+3Fe3O4 ![]() 4Al2O3+9Fe.该反应是(填“放热”或“吸热”)反应,反应中的还原剂是(填化学式).
4Al2O3+9Fe.该反应是(填“放热”或“吸热”)反应,反应中的还原剂是(填化学式).
(2)钠元素有NaCl、Na2O2、NaHCO3、Na2SiO3等多种重要的化合物.请根据题意选择钠的化合物的化学式填空:其中常用来作为潜水艇和呼吸面具中氧气来源的淡黄色固体是 , 常用来烘制糕点,也可用作抗酸药的是 .
(3)向FeCl2溶液中通入Cl2 , 反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl﹣ . 向所得溶液中滴加KSCN溶液,溶液变成色,我们可以利用这一现象检验Fe3+的存在.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镓有“电子工业脊梁”的美誉,镓及其化合物应用广泛。
(1) 镓(Ga)的原子结构示意图为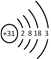 ,镓元素在周期表中的位置是_______。
,镓元素在周期表中的位置是_______。
(2)镓能与沸水剧烈反应生成氢气和氢氧化镓,该反应的化学方程式是______________。
(3)氮化镓在电和光的转化方面性能突出,是迄今理论上光电转化效率最高的材料。
资料:镓的熔点较低(29.8℃),沸点很高(2403℃)。
①传统的氮化镓(GaN)制备方法是采用GaCl3与NH3在一定条件下反应,该反应的化学方程式是____________________。
②当代工业上固态氮化镓(GaN)的制备方法是利用镓与NH3在1000℃高温下合成,同时生成氢气,每生成l mol H2时放出10.27 kJ热量。该可逆反应的热化学方程式是 ____________________________________。
③在密闭容器中,充入一定量的Ga与NH3发生上述反应,实验测得反应平衡体系中NH3的体积分数与压强P和温度T的关系曲线如图1所示。
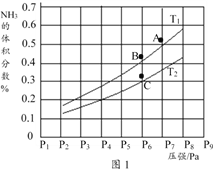
图中A点和C点化学平衡常数的关系是:KA_____ KC (填“>”“=”或“<”),理由是_____________________________。
(4)电解法可以提纯粗镓,具体原理如图2所示:
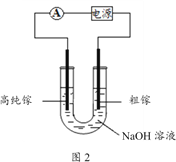
①粗镓与电源____极相连。(填“正”或“负”)
②镓在阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2-,GaO2-在阴极放电的电极反应式是
_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L 恒容密闭容器中,发生反应:X(g)+Y(g)═2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表:下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率ν(Z)=2.0×10﹣5 mol/(Lmin)
B.4min时,ν(逆)>ν(正)
C.该温度下,此反应的平衡常数K=1.44
D.7min时,反应还未达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量 变化如图(其中I代表H2A,Ⅱ代表HA﹣ , Ⅲ代表A2﹣).根据图示判断,下列说法正确的是( ) 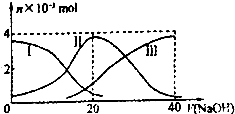
A.当V(NaOH)=20mL时,溶液中离子浓度大小关系 c(Na+)>c(HA﹣)>c(H+)>c(A2﹣)>c(OH﹣)
B.等体积等浓度的NaOH溶液与H2A溶液混合后其溶液中水的电离程度比纯水大
C.欲使NaHA溶液呈中性,可以向其中加入酸或碱
D.向NaHA溶液加人水的过程中,pH可能增大也可能减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(实验内容及记录)
实验编号 | 实验温度 | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请完成此实验设计,其中:V1=________,V2=__________。
(2)实验①、②探究的是_____________对化学反应速率的影响,根据上表中的实验数据,可以得到的结论是______________________________________。
(3)探究温度对化学反应速率的影响,应选择________________(填实验编号)。
(4)利用实验1中的数据,计算用KMnO4表示的化学反应速率为__________。
(5)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。

该小组同学根据图2所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||||
④ | 25 | 2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t |
①该小组同学提出的假设是__________________________________________。
②若该小组同学提出的假设成立,应观察到_____________________________现象。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com