
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(实验内容及记录)
实验编号 | 实验温度 | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请完成此实验设计,其中:V1=________,V2=__________。
(2)实验①、②探究的是_____________对化学反应速率的影响,根据上表中的实验数据,可以得到的结论是______________________________________。
(3)探究温度对化学反应速率的影响,应选择________________(填实验编号)。
(4)利用实验1中的数据,计算用KMnO4表示的化学反应速率为__________。
(5)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。

该小组同学根据图2所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||||
④ | 25 | 2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t |
①该小组同学提出的假设是__________________________________________。
②若该小组同学提出的假设成立,应观察到_____________________________现象。
【答案】 V1=2.0 V2=3.0 浓度 其他条件不变时,增大(减小)反应物浓度,加快(减慢)化学反应速率 ②③ 1.0×10-2mol/(L·min) Mn2+对该反应有催化作用 加入MnSO4固体后,KMnO4溶液比实验②更快褪色
【解析】(1)利用实验②、③中的数据,可知溶液的总体积为10.0mL,所以实验①中V1=2.0mL,V2=3.0mL;(2)实验①、②其他条件相同,只有H2C2O4浓度不同,则实验①、②探究的是浓度对反应速率的影响,根据表中的实验数据,实验①的草酸浓度大,溶液褪至无色所需时间更短,则浓度大,反应速率大;(3)实验②和③的温度不同,其他条件相同;(4)溶液褪至无色即KMnO4反应完所需时间为1.5min,计算出用KMnO4表示的化学反应速率;(5)①由图2可知,反应开始后锰离子浓度增大,反应速率增加的比较快,所以探究的是锰离子在反应中的作用;②若反应加快,说明Mn2+是催化剂,反应过程中溶液褪色时间减少。
(1)实验①、②探究浓度对反应速率的影响,则其他条件应该是相同的,则溶液总体积应相同,故V1= 2.0mL;实验②、③是探究温度对反应速率的影响,则其他条件应该是相同的,则V2=3.0mL;(2)根据表中数据可知实验①、②探究的是浓度对化学反应速率的影响,根据上表中的实验数据,可以得到的结论是其他条件不变时,增大(减小)反应物浓度,加快(减慢)化学反应速率;(3)根据表中数据可知探究温度对化学反应速率的影响,应选择②③;(4)草酸的物质的量为:0.6mol/L×0.003L=0.0018mol,高锰酸钾的物质的量为:0.05mol/L×0.003L=0.00015mol,草酸和高锰酸钾的物质的量之比为:0.0018mol:0.00015mol=12:1,显然草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为:![]() =0.015mol/L,这段时间内平均反应速率v(KMnO4)=
=0.015mol/L,这段时间内平均反应速率v(KMnO4)=![]() =0.01 mol/(Lmin);(5)①由图乙可知,反应开始后速率增大的比较快,说明生成物中的MnSO4(或Mn2+)为该反应的催化剂;②若该小组同学提出的假设成立,则反应速率加快,即加入MnSO4固体后,KMnO4溶液比实验②更快褪色。
=0.01 mol/(Lmin);(5)①由图乙可知,反应开始后速率增大的比较快,说明生成物中的MnSO4(或Mn2+)为该反应的催化剂;②若该小组同学提出的假设成立,则反应速率加快,即加入MnSO4固体后,KMnO4溶液比实验②更快褪色。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E5种微粒,它们可能是原子或离子,并且组成它们的元素的原子序数都小于18。A微粒的最外层电子数比次外层多5个;金属原子B的原子核内质子数比前一周期的同族元素多8个,其单质不能从CuSO4溶液中置换出Cu;C元素有3种同位素:C1、C2、C3,C1的质量数分别为C2、C3的![]() 和
和![]() ;D元素的气态氢化物溶于水后显碱性;E是由两种不同元素组成的带负电荷的微粒,它共有2个原子核10个电子,E极易与C+结合成中性微粒。
;D元素的气态氢化物溶于水后显碱性;E是由两种不同元素组成的带负电荷的微粒,它共有2个原子核10个电子,E极易与C+结合成中性微粒。
(1)写出五种微粒的表示符号:A________、B________、C________、D________、E________。
(2)写出C的同位素名称:C1________、C2________、C3________。
(3)C和D形成的10个电子的分子的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)![]() Y(g)+Z(g),达到反应限度的标志是
Y(g)+Z(g),达到反应限度的标志是
①X的分解速率与X的生成速率相等 ②反应容器中压强不再变化
③X、Y、Z的浓度不再变化 ④单位时间内生成1molY的同时生成1molZ
A.①③ B.②③ C.①② D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素周期表的说法正确的是( )
A.元素周期表有18个族
B.元素周期表有七个周期
C.IA族的元素全部是金属元素
D.短周期是指第一、二、三、四周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在水溶液中有四种含铁型体,250C时,它们的物质的量分数随PH的变化如图所示,下列叙述错误的是
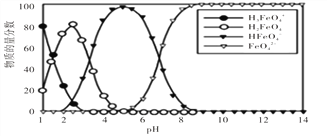
A. 向pH=5的高铁酸盐溶液中加入NaOH溶液,离子方程式为:HFeO4-+OH-=FeO42-+H2O
B. 为获得尽可能纯净的高铁酸盐,应控制pH≥9
C. 已知H3FeO4+的电离平衡常数分别为:K1=2.5×10-2 ,K2=4.8×10-4,K3=5.0×10-8,当pH=4时,溶液中c(HFeO4-)/c(H2FeO4)=1.2
D. pH=2时,溶液中含铁粒子浓度的大小关系为:c(H2FeO4)>c(H3FeO4+)>c(HFeO4-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实,写出下列反应的热化学方程式。
(1)在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程式为 。
(2)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量,则表示该反应的热化学方程式为 。
(3)NA为阿伏加德罗常数,C2H2(g)完全燃烧生成CO2和液态水的反应,有5NA个电子转移时,放出650 kJ的热量,该反应的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.同周期元素中,ⅠA族元素的原子半径最小
B.仅由非金属元素不可能形成离子化合物
C.目前使用的元素周期表中,最长的周期含有32种元素
D.凡是有化学键断裂的过程一定发生了化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)改善空气质量、保护水土资源是实现美丽中国的基础。
①下列气体的排放会导致酸雨形成的是________(填字母,下同)。
a. CH4 b. CO c. SO2
②下列处理废水的方法属于中和法的是________。
a. 用熟石灰处理废水中的酸
b. 用臭氧处理废水中的氰化物
c. 用铁粉回收废水中的铜
③下列做法会造成土壤重金属污染的是________。
a. 作物秸杆露天焚烧
b. 废干电池就地填埋
c. 废旧塑料随意丢弃
(2)新鲜牛肉含蛋白质、脂肪、糖类、维生素A、维生素C、钙、铁等,其中:
①属于人体所需微量元素的是________。
②属于脂溶性维生素的是________。
③可为人体提供能量的是________、________和________。
(3)材料的发展与应用促进了人类社会的进步。
①碳晶地暖环保、节能、安全,其构造如图所示。其中属于金属材料的是________;属于硅酸盐材料的是________;属于高分子材料的是挤塑板和________。
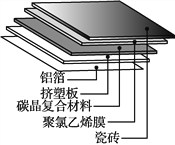
②吸附材料具有多孔、表面积大的特点。活性炭吸附NO2的过程中,会伴有C与NO2的反应,产物为两种常见无毒气体。写出该反应的化学方程式:_________________________________________。
③LiMn2O4是锂离子电池的一种正极材料,可通过MnO2与Li2CO3煅烧制备,同时还生成CO2和一种单质。写出该反应的化学方程式:_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com