工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H
2(g)?CH
3OH(g).如图中甲图表示反应过程中能量的变化情况;乙图表示一定温度下,在体积为2L的密闭容器中加入4mol H
2和一定量的CO后,CO和CH
3OH(g)的浓度随时间的变化情况.
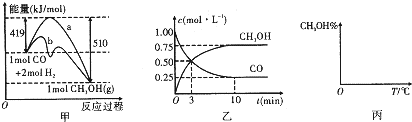
请回答下列问题.
(1)下列说法正确的是
(填字母序号).
a.在甲图中,曲线b表示使用了催化剂
b.起始充入的CO为2mol,从反应开始到达到平衡,v(H
2)=0.075mol?L
-1?min
-1,
c.增大CO的浓度,CO的转化率增大
d.容器中压强恒定时,说明反应已达平衡状态
e.保持温度和密闭容器的容积不变,再充入1mol CO和2mol H
2,再次达到平衡时
的值会变小
(2)该温度下CO(g)+2H
2 (g)?CH
3OH(g)的化学平衡常数为
.若保持其他条件不变,将反应体系升温,则该反应的化学平衡常数
(填“增大”“减小”或“不变”).
(3)请在丙图所示坐标图中画出平衡时甲醇的百分含量(纵坐标)随温度(横坐标)的变化曲线,要求画出压强不同的两条曲线(在曲线上标出P
1、P
2且P
1<P
2).
(4)已知CH
3OH(g)+
O
2(g)═C0
2(g)+2H
2O(g)△H=-192.9kJ/mol,又知H
20(1)═H
2O(g)△H=+44kJ/mol,请写出32g CH
3OH(g)完全燃烧生成CO
2和液态水的热化学方程式
.


 ,故答案为:
,故答案为: ;
;


 已知NaCl的摩尔质量为58.5g.mol-1,食盐晶体的密度为ρ.gcm-3,若如图中Na+与最邻近Cl-的核间距离为acm,那么阿伏加德罗常数可表示为( )
已知NaCl的摩尔质量为58.5g.mol-1,食盐晶体的密度为ρ.gcm-3,若如图中Na+与最邻近Cl-的核间距离为acm,那么阿伏加德罗常数可表示为( )