
【题目】pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH。已知H2CO3溶液中存在下列平衡:CO2+H2O![]() H2CO3 H2CO3
H2CO3 H2CO3![]() H+ + HCO3- HCO3-
H+ + HCO3- HCO3-![]() H+ + CO32-,下图为H2CO3、HCO3— 、CO32—在加入强酸或强碱溶液后达到平衡时溶液中三种成分的pC-pH图。
H+ + CO32-,下图为H2CO3、HCO3— 、CO32—在加入强酸或强碱溶液后达到平衡时溶液中三种成分的pC-pH图。

(1)在pH=11时,H2CO3溶液中浓度最大的含碳元素的离子为__________。
(2)由图可知,碳酸的一级电离常数Ka1大约为______
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
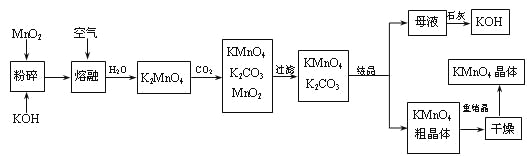
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列___(填序号)物质相似。
A.75%酒精 B.双氧水 C.苯酚 D.84消毒液(NaClO溶液)
(2)写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:
___________________________________________________________________。
(3)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是:_______。
(4)上述流程中可以循环使用的物质有石灰、二氧化碳、___和___(写化学式)。
(5)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得_____mol KMnO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条作下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H<0。查阅资料知SO3的熔点为16.83℃,沸点是448℃。某化学学习小组欲通过实验测定上述反应中SO2的转化率,他们设计了如下实验。
2SO3(g) △H<0。查阅资料知SO3的熔点为16.83℃,沸点是448℃。某化学学习小组欲通过实验测定上述反应中SO2的转化率,他们设计了如下实验。
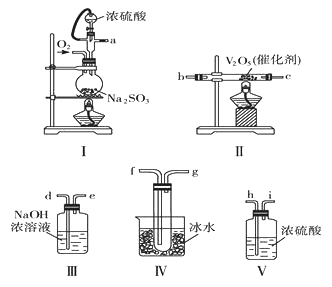
请根据要求回答问题:
(1)各装置接口的连接顺序是a→_________________。
(2)装置Ⅳ烧杯中盛放冰水的作用是_____________________。
(3)装置Ⅰ所用硫酸,一般选用浓度为70%~80%的硫酸,原因是_________________。
(4)当装置Ⅰ中反应结束时,要打开止水夹继续通入O2一段时间,继续通入O2的目的是_______。
(5)称量agNa2SO3粉末与足量硫酸反应,实验结束后称得装置Ⅳ增重bg,列式表示该实验中SO2的转化率__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备。工艺流程如下:
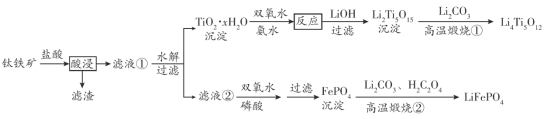
“酸浸”后,钛主要以![]() 形式存在,若“滤液②”中c(Mg2+)=0.02 mol ·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5mol·L-1,此时是否有Mg3(PO4)2沉淀生成? 已知FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-2 _____________(列式计算)。
形式存在,若“滤液②”中c(Mg2+)=0.02 mol ·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5mol·L-1,此时是否有Mg3(PO4)2沉淀生成? 已知FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-2 _____________(列式计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化磷(PCl3)是一种重要的有机合成催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如图所示。

已知: PCl3熔点为-112℃,沸点为75.5℃。易被氧化,遇水易水解。与Cl2反应生成PCl5。
(1)A中反应的化学方程式为__________________。
(2)B中所装试剂名称是___________________,E中碱石灰的作用是___________________。
(3)实验时,检查装置气密性后,向C装置的曲颈甑中加入红磷,打开止水夹K通入干燥的CO2,一段时间后,关闭K,加热曲颈甑至上部有黄色升华物出现时通入氯气,反应立即进行。通干燥CO2的作用是____________________。CO2______(选填“能”或“不能”)用Cl2代替,理由是________________。
(4)D中烧杯中盛装__________,其作用是_______________。
(5)PCl3水解得到亚磷酸(分子式:H3PO3。二元弱酸),写出亚磷酸钠被浓硝酸氧化的离子方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种邮寄材料中间体。实验室由芳香烃A制备H的一种合成路线如下:
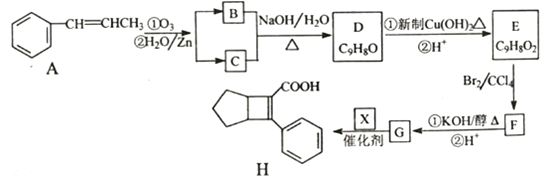
已知:①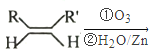 RCHO+RCHO
RCHO+RCHO
②RCHO+RCH2CHO![]() +H2O
+H2O
③![]()
请回答下列问题:
(1)芳香化合物B的名称为_________,C的同系物中相对分子质量最小的结构简式为__________。
(2)由E生成F的反应类型为_________。
(3)X的结构简式为_________。
(4)写出D生成E的第①步反应的化学方程式_______________。
(5)G与乙醇发生酯化反应生成化合物Y,Y有多种同分异构体,其中符合下列条件的同分异构体有____种,写出其中任意一种的结构简式________。
①分子中含有苯环,且能与饱和碳酸氢钠溶液反应放出CO2;
②其核磁共振氢谱显示有4种不同化学键环境的氢,且峰面积之比为6:2:1:1。
(6)写出用![]() 为原料制备化合物
为原料制备化合物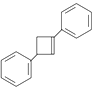 的合成路线,其他无机试剂任选。________
的合成路线,其他无机试剂任选。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定容积的密闭容器中,可逆反应:mA(g)+nB(g) ![]() pC(g)+qD(g)中,当m、n、p、q为任意正整数时,达到平衡的标志是( )
pC(g)+qD(g)中,当m、n、p、q为任意正整数时,达到平衡的标志是( )
A.体系压强不再发生变化
B.各组分的物质的量浓度不再改变
C.各组分的质量分数相等
D.反应速率vA∶vB∶vC∶vD=m∶m∶p∶q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应![]() ,在密闭容器中达到平衡状态,下列说法正确的是( )
,在密闭容器中达到平衡状态,下列说法正确的是( )
A.体积不变,加少许![]() 化学平衡正向移动,再达到平衡状态时与原平衡相比颜色变深
化学平衡正向移动,再达到平衡状态时与原平衡相比颜色变深
B.加压时(体积变小),将使正反应速率增大,逆反应速率减慢
C.体积不变,加少许![]() ,化学平衡逆向移动,再达到平衡状态时与原平衡相比颜色变浅
,化学平衡逆向移动,再达到平衡状态时与原平衡相比颜色变浅
D.保持体积不变,升高温度,化学平衡正向移动,再达到平衡状态时混合气体密度变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 氢氧化钡溶液中加入硫酸铵:Ba2++OH-+NH4++SO42-=BaSO4↓+NH3·H2O
B. 用惰性电极电解CuCl2溶液:Cu2++2Cl-+2H2O![]() Cu(OH)2↓+H2↑+Cl2↑
Cu(OH)2↓+H2↑+Cl2↑
C. 向漂白粉溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
D. 向苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com