
【题目】如图所示,A、B、C三个装置中的烧杯分别盛有足量的CuCl2溶液。
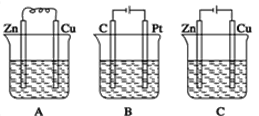
(1)A、B、C三个装置中属于原电池的是___(填标号)。
(2)A池中Zn是___极,电极反应式为___;A中总反应的离子方程式___。
(3)B池中总反应的方程式为___。
(4)C池中Zn是___极,发生___反应,电极反应式为___;反应过程中,CuCl2溶液浓度___(填“变大”“变小”或“不变”)。
【答案】A 负 Zn-2e-=Zn2+ Zn+Cu2+=Zn2++Cu CuCl2![]() Cu+Cl2↑ 阴 还原 Cu2++2e-=Cu 不变
Cu+Cl2↑ 阴 还原 Cu2++2e-=Cu 不变
【解析】
(1)A、B、C三个装置中,没有外接电源的属于原电池。
(2)A池中,相对活泼的金属作负极,电极反应式为金属失电子生成金属离子;A中总反应为负极金属与电解质发生氧化还原反应。
(3)B池中总反应为电解氯化铜。
(4)C池中,与正极相连的电极为阳极,阳极失电子发生氧化反应;通过分析两电极反应,可确定反应过程中,CuCl2溶液浓度变化情况。
(1)A、B、C三个装置中,没有外接电源的属于原电池,则原电池是A。答案为:A;
(2)A池中,相对活泼的金属是Zn,Zn是负极,电极反应式为Zn-2e-=Zn2+;A中总反应的离子方程式为Zn+Cu2+=Zn2++Cu。答案为:负;Zn-2e-=Zn2+;Zn+Cu2+=Zn2++Cu;
(3)B池中总反应,就是电解氯化铜的反应,方程式为CuCl2![]() Cu+Cl2↑。答案为:CuCl2
Cu+Cl2↑。答案为:CuCl2![]() Cu+Cl2↑;
Cu+Cl2↑;
(4)C池中,与负极相连的电极为阴极,Zn与电源负极相连,是阴极,得电子,发生还原反应,电极反应式为Cu2++2e-=Cu;反应过程中,阳极Cu-2e-=Cu2+,生成的Cu2+与阴极消耗的Cu2+物质的量相等,则CuCl2溶液浓度不变。答案为:阴;还原;Cu2++2e-=Cu;不变。


科目:高中化学 来源: 题型:
【题目】下列有关图中有机物的说法错误的是( )

A.该有机物的分子式为C8H9O4Br
B.1mol该有机物最多可以与3molH2反应
C.能发生酯化反应、水解反应、氧化反应
D.1mol该有机物与NaHCO3溶液反应时,最多消耗1molNaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能够跟1mol ![]() 起反应的Br2或H2的最大用量分别是
起反应的Br2或H2的最大用量分别是
A.1mol,1molB.3.5mol,7mol
C.1mol,7molD.6mol,7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O="O " dkJ·mol—1。

根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A. (6a+5d-4c-12b)kJ·mol—1B(4c+12b-6a-5d)kJ·mol—1 B. (4c+12b-4a-5d)kJ·mol—1
C. (4a+5d-4c-12b)kJ·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的前四周期元素,X、Z的周期序数=族序数,由这四种元素组成的单质或化合物存在如图所示的转化关系,其中甲、戊是两常见的金属单质,丁是非金属单质,其余为氧化物且丙为具有磁性的黑色晶体。下列说法正确的是

A.丙属于碱性氧化物
B.W元素在周期表中的位置是第四周期VIIIB族
C.W的原子序数是Z的两倍,金属性弱于Z
D.常温下等物质的量的甲和戊加入过量浓硝酸中,消耗的HNO3物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】数十年来,化学工作者对氮的氧化物、碳的氧化物做了广泛深入的研究并取得一些重要成果。
I.已知2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
第一步:2NO(g) ![]() N2O2(g) (快) H1<0;v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
N2O2(g) (快) H1<0;v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
第二步:N2O2(g)+O2(g) ![]() 2NO2(g) (慢) H2< 0; v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
2NO2(g) (慢) H2< 0; v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
①2NO(g)+O2(g) ![]() 2NO2(g)的反应速率主要是由______(填“第一步”或“第二步”)反应决定。
2NO2(g)的反应速率主要是由______(填“第一步”或“第二步”)反应决定。
②一定温度下,反应2NO(g)+O2(g) ![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=____________;
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=____________;
II.利用CO2和CH4重整不仅可以获得合成气(主要成分为CO、H2),还可减少温室气体的排放(1)已知重整过程中部分反应的热化方程式为:
① CH4(g)=C(s)+2H2(g) ΔH>0
② CO2(g)+H2(g)=CO(g)+H2O(g) ΔH>0
③ CO(g)+H2(g)=C(s)+H2O(g) ΔH<0
固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率见图甲。
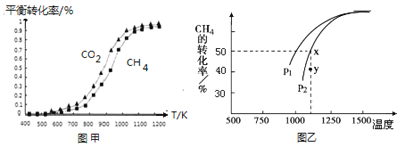
同温度下CO2的平衡转化率________(填“大于”“小于”或“等于”)CH4的平衡转化率。
(2)在密闭容器中通入物质的量均为0.1mol的CH4和CO2,在一定条件下发生反应CO2(g) + CH4(g) ![]() 2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)_____v(逆)(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x点对应温度下反应的平衡常数Kp=__________________。
2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)_____v(逆)(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x点对应温度下反应的平衡常数Kp=__________________。
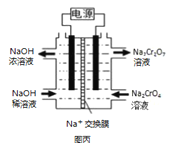
III.根据2CrO42﹣+2H+ ![]() Cr2O72﹣+H2O设计如图丙装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图丙中右侧电极连接电源的__极,电解制备过程的总反应方程式为__。测定阳极液中Na和Cr的含量,若Na与Cr的物质的量之比为a:b,则此时Na2CrO4的转化率为__。若选择用熔融K2CO3作介质的甲醇(CH3OH)燃料电池充当电源,则负极反应式为__。
Cr2O72﹣+H2O设计如图丙装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图丙中右侧电极连接电源的__极,电解制备过程的总反应方程式为__。测定阳极液中Na和Cr的含量,若Na与Cr的物质的量之比为a:b,则此时Na2CrO4的转化率为__。若选择用熔融K2CO3作介质的甲醇(CH3OH)燃料电池充当电源,则负极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是光合作用过程的图解,图中甲、乙、丙、丁表示能量或物质,①、②表示过程。据图回答:
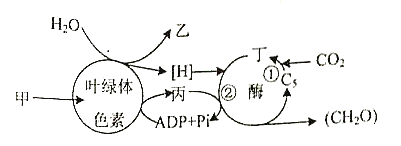
(1)甲表示__________,它可转变为储存在丙中的__________。
(2)物质乙是__________,美国科学家鲁宾和卡门利用同位素标记法进行探究,证明了光合作用产生的乙全部来自__________。
(3)物质丁是__________,过程①叫做__________,过程②所需的还原剂是图中的__________。突然停止光照,短时间内叶绿体中C5的含量__________(填“增加”“不变”或“减少”)。
(4)写出光合作用的总反应式:______________________________。
(5)植物光合作用强度受多种环境因素的影响。冬季蔬菜大棚主要是通过改变__________来提高光合作用强度。为提高蔬菜产童,菜农常向大棚内施加有机肥以增加__________和__________的供应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学用语的理解正确的是( )
A.乙烯的结构简式:CH2CH2
B.电子式![]() 可以表示氢氧根离子,也可以表示羟基
可以表示氢氧根离子,也可以表示羟基
C.比例模型![]() 可以表示甲烷分子,也可以表示四氯化碳分子
可以表示甲烷分子,也可以表示四氯化碳分子
D.结构示意图![]() 可以表示35Cl-,也可以表示37Cl-
可以表示35Cl-,也可以表示37Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氯酸钠(NaClO3)等为原料制备亚氯酸钠(NaClO2)的工艺流程如下,下列说法中,不正确的是
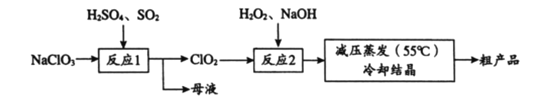
A. 反应1中,每生成1 mol ClO2有0.5 mol SO2被氧化
B. 从母液中可以提取Na2SO4
C. 反应2中,H2O2做氧化剂
D. 采用减压蒸发可能是为了防止NaClO2受热分解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com