
| 实验序号 | a | b | c |
| 合金质量(mg) | 510 | 765 | 918 |
| 气体体积(mL) | 560 | 672 | 672 |
| ||
| ||
| 16×3 |
| 16×3+27×2 |
| 24g |
| xg |
| 22.4L |
| VL |
| 54g |
| yg |
| 67.2L |
| VL |
| 0.03mol×2 |
| 0.03L |
| 3 |
| 2 |
| 0.560L |
| 22.4L/mol |
| 0.01mol×24g/mol |
| 0.510g |


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
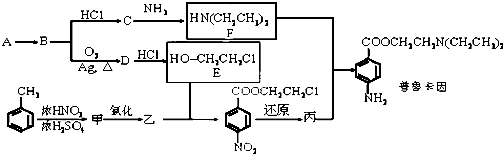
 )是其中的一种,它可以从茉莉花中提取.一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取.一种合成路线如下: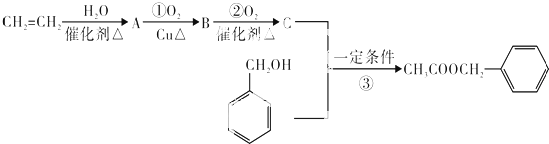
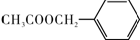 )的说法正确的是
)的说法正确的是查看答案和解析>>
科目:高中化学 来源: 题型:
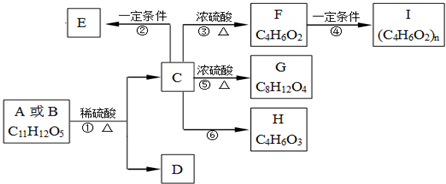
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
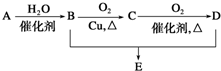 有机物A的产量是衡量一个国家石油工业发展水平的标志,可发生以下系列转化,B、D是生活中常见的两种有机物,下列说法不正确的是( )
有机物A的产量是衡量一个国家石油工业发展水平的标志,可发生以下系列转化,B、D是生活中常见的两种有机物,下列说法不正确的是( )| A、A的结构简式为CH2=CH2 |
| B、1molB物质可以与足量Na反应生成0.5molH2 |
| C、B、D、E三种物质可以用饱和Na2CO3溶液鉴别 |
| D、由B、D制备E浓H2SO4只作吸水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
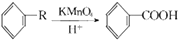 ,从A出发发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体.
,从A出发发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体.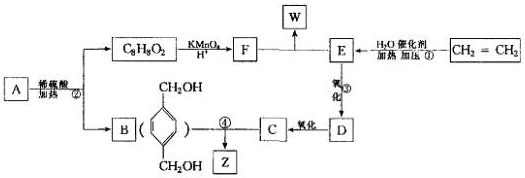
查看答案和解析>>
科目:高中化学 来源: 题型:
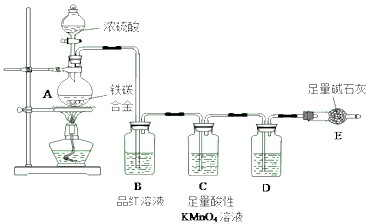
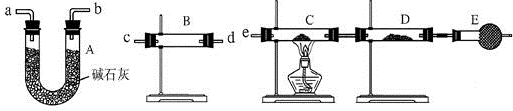
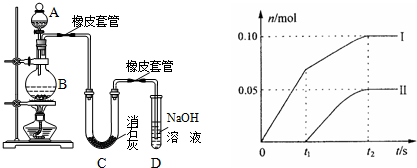
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com