
【题目】我国科学工作者从环境污染物中分离出一株假单胞菌,该菌株能够在分解有机物的同时产生电能,其原理如图所示。下列说法正确的是( )

A.电流由左侧电极经过负载后流向右侧电极
B.当1mol O2参与电极反应时,从左侧穿过质子交换膜进入右侧的H+数目为4NA
C.放电过程中,H2PCA不断被消耗,需要实时补加
D.负极的电极反应式为:H2PCA+2e- =PCA + 2H+
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(25℃) | Ka = 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
① 0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3-)(填“>”、“<”或“=”)。
②常温下,pH相同的三种溶液:A.CH3COONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是________(填编号)。
③已知25℃时,CH3COOH(aq)+OH-( aq)=CH3COO-(aq) +H2O △H=-akJ/mol,H+(aq) +OH-(aq) =H2O △H=-b kJ/mol,醋酸电离的热化学方程式为________________。
④将少量CO2通入NaCN溶液,反应的离子方程式是____________________________。
⑤室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是______________,溶液中c(CH3COO-)/c(CH3COOH) =___________。
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。
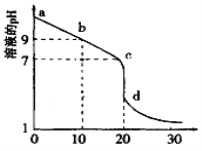
① d点所示的溶液中离子浓度由大到小的顺序依次为____________。
② b点所示的溶液中c(NH3·H2O)-c(NH4+)=_________(用溶液中的其它离子浓度表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是
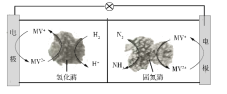
A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能
B. 阴极区,在氢化酶作用下发生反应H2+2MV2+![]() 2H++2MV+
2H++2MV+
C. 正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D. 电池工作时质子通过交换膜由负极区向正极区移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是

A.a=6.00
B.同时改变反应温度和蔗糖的浓度,v可能不变
C.b<318.2
D.不同温度时,蔗糖浓度减少一半所需的时间相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】樱桃是一种抗氧化的水果,对人体有很大的益处,樱桃中含有一种羟基酸![]() 具有健脾作用。下列有关说法正确的是
具有健脾作用。下列有关说法正确的是
A.该羟基酸含有3种官能团
B.通常条件下,该羟基酸可以发生取代、氧化和加成反应
C.该羟基酸可以在Cu的催化下被O2氧化成醛
D.含1mol该羟基酸的溶液可与含2mol氢氧化钠的溶液恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易反应生成一种无氧酸和两种氮的常见氧化物。亚硝酰氯应用广泛,可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组同学拟制备原料气NO和Cl2,制备装置如图所示,为制备纯净干燥的气体,补充右表中缺少的药品。
装置Ⅰ | 装置Ⅱ | ||
蒸馏烧瓶中 | A仪器中 | ||
制备纯净的Cl2 | MnO2 | ①______ | ②______ |
制备纯净的NO | Cu | ③______ | ④______ |
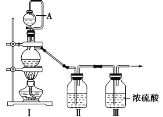
(2)乙组同学对甲组同学制取NO的装置略加改良,结合甲组制得的Cl2共同制备NOCl,装置如图所示:
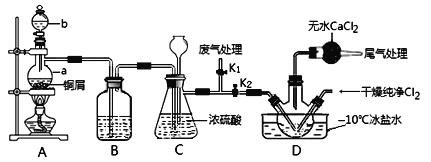
①仪器b的名称为________________。
②组装好实验装置后应先______________,然后依次装入药品。此实验关键操作有两点:一是将Cl2充满D装置的三颈瓶中;二是A中反应开始时要先关闭K2,打开K1,待NO充满装置后再关闭K1,打开K2。这两步操作中充满的目的都是__________________________________________________。
③若C装置中压强过大,可以观察到的现象是_________________________。
④装置D中冰盐水的作用是__________________。
(3)亚硝酰氯(NOCl)纯度的测定:将所得亚硝酰氯(NOCl)产品13.10g溶于水,配制成250mL溶液;取出25.00mL,以K2CrO4溶液为指示剂,用0.8mol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为 22.50mL。(已知:Ag2CrO4为砖红色固体)
①亚硝酰氯(NOCl)与水反应的化学方程式为_________________________。
②亚硝酰氯(NOCl)的质量分数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请阅读下列材料,完成下面小题。
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。其工业合成原理为:
①2Fe(OH)3+3NaClO+10NaOH=2Na2FeO4+6NaCl+8H2O
②Na2FeO4+2KOH![]() K2FeO4↓+2NaOH
K2FeO4↓+2NaOH
高铁酸钾与水反应生成Fe(OH)3胶体和氧气等。
【1】关于反应①下列说法正确的是
A.Fe(OH)3得到电子B.NaClO失去电子
C.NaClO被还原D.NaOH是氧化剂
【2】反应②属于
A.化合反应B.分解反应C.置换反应D.复分解反应
【3】关于反应②下列说法正确的是
A.减小Na2FeO4浓度能够加快反应速率
B.增大KOH浓度能够加快反应速率
C.升高温度可以减慢反应速率
D.加入足量的KOH可以使Na2FeO4100%转化为K2FeO4
【4】NaClO属于
A.氧化物B.酸C.碱D.盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X与气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如表:下列说法正确的是( )
t∕min | 2 | 4 | 7 | 9 |
n(Y)∕mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前4min的平均反应速率υ(Z)=0.0125molL-1min-1
B. 其他条件不变,降低温度,反应达到新平衡前υ(逆)>υ(正)
C. 其他条件不变,再充入0.2molZ,达平衡时X的体积分数增大
D. 该温度下此反应的平衡常数K=1.44
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com