
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
科目:高中化学 来源: 题型:
【题目】温度为T1时,将气体X和气体Y各1.6mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 1.2 | 1.1 | 1.0 | 1.0 |
A. 反应0~4 min的平均速率υ(Z)=0.25 mol/(Lmin)
B. T1时,反应的平衡常数K1=1.2
C. 其他条件不变,9 min后,向容器中再充入1.6 molX,平衡向正反应方向移动,再次达到平衡时X的浓度减小,Y的转化率增大
D. 其他条件不变,降温到T2达到平衡时,平衡常数K2=4,则此反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等。可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得。工艺流程如下图:
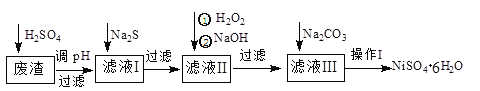
请回答下列问题:
(1)用稀硫酸溶解废渣时,为了提高浸取率可采取的措施有_________________(任写一点)。
(2)向滤液中滴入适量的Na2S溶液,目的是除去Cu2+、Zn2+,写出除去Cu2+的离子方程式:____________________________________________。
(3)在40℃左右,用6%的H2O2氧化Fe2+,再在95℃时加入NaOH调节pH,除去铁和铬。此外,还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。如图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域[已知25℃时,Fe(OH)3的Ksp=2.64×10-39]。
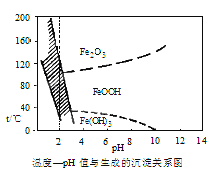
下列说法正确的是(选填序号)_______。
a. FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.6×10-29mol·L-1
c.用氯酸钠在酸性条件下氧化Fe2+的离子方程式为6Fe2++C1O3-+6H+=6Fe3++C1-+3H2O
d.工业生产中常保持在85~95℃生成黄铁钒钠,此时水体的pH约为3
(4)上述流程中滤液I的主要成分是___________。
(5)操作I的实验步骤依次为(实验中可选用的试剂:6mol·L-1的H2SO4溶液、蒸馏水、pH试纸):
①___________;②___________;③蒸发浓缩、冷却结晶,过滤得NiSO4·6H2O晶体:④用少量乙醇洗涤NiSO4·6H2O晶体并晾干。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别调节0.01mol·L-1HCOOH溶液、0.01mol·L-1氨水的pH,系统中微粒浓度的负对数值(-lgc)与pH的关系分别如下图所
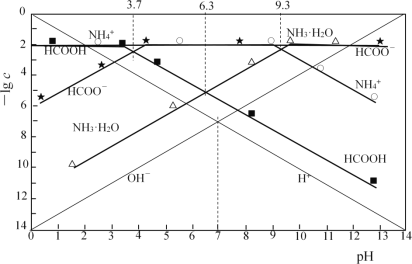
下列说法错误的是
A. 25℃时,NH3·H2O![]() NH4++OH-的lgK=-4.7
NH4++OH-的lgK=-4.7
B. 25℃时,0.01mol·L-1HCOOH溶液的pH为3.7
C. HCOONa溶液中加入NH4Cl至溶液呈中性:c(Cl-)>c(Na+)>c(HCOO-)
D. HCOONa溶液中加入KHSO3至溶液呈中性:c(HCOOH) +c(H2SO3) = c(SO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaH2PO2(次磷酸钠)易溶于水,水溶液近中性,具有强还原性,可用于化学镀银、镍、铬等。一种利用泥磷(含P4和少量CaO、Fe2O3、Al2O3、CaCl2等)为原料制备NaH2PO2·H2O的工艺流程如下:
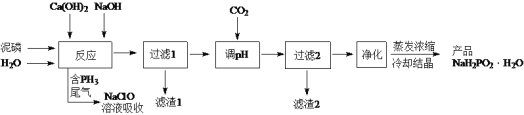
已知P4与两种碱的反应主要有:
Ⅰ. 2Ca(OH)2+P4+4H2O=2Ca(H2PO2)2+2H2↑
Ⅱ. 4NaOH + P4+8H2O = 4NaH2PO2·H2O+2H2↑
Ⅲ. 4NaOH + P4+2H2O = 2Na2HPO3 +2PH3↑
Ⅳ. NaH2PO2+NaOH = Na2HPO3+H2↑
(1)尾气中的PH3被NaClO溶液吸收生成NaH2PO2和NaCl的离子方程式为_____。
(2)“反应”在温度和水量一定时,混合碱总物质的量与P4的物质的量之比[n(碱)/ n(磷)]与NaH2PO2产率的关系如图所示。当n(碱)/ n(磷)>2.6时,NaH2PO2的产率随n(碱)/ n(磷)的增大而降低的可能原因是_____。

(3)通CO2“调pH”至溶液的pH约为_____,滤渣2主要成分为_____(填化学式)。
(4)“过滤2”的滤液须用Ag2SO4、Ba(OH) 2及Na2S溶液除去其中Cl-及Fe2+等,其中加入的Ag2SO4溶液不宜过量太多,其主要原因是_____。
(5)用NiCl2、NaH2PO2溶液化学镀Ni,同时生成H3PO4和氯化物的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ca(NO2)2(亚硝酸钙)是易溶于水的无色晶体,可用作混凝土中钢筋的防护剂。
(1)Ca(NO2)2的制备方法很多。
①实验室可用反应Ca(NO3)2+2CaFe2O4+4NO![]() 3Ca(NO2)2+2Fe2O3制备Ca(NO2)2,该反应中被氧化的N原子与被还原的N原子的物质的量之比为_____。
3Ca(NO2)2+2Fe2O3制备Ca(NO2)2,该反应中被氧化的N原子与被还原的N原子的物质的量之比为_____。
②用石灰乳吸收硝酸工业尾气中氮氧化物制备Ca(NO2)2,其中NO2与Ca(OH)2反应生成Ca(NO2)2和Ca(NO3)2的化学方程式为_____,经过滤得到含Ca(NO2)2的溶液为液态产品。
(2)测定某液态产品中NO3-含量的步骤如下:
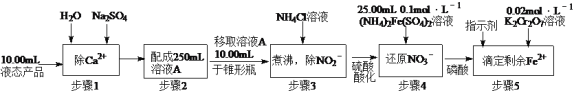
已知:步骤4中的反应为NO3—+3Fe2++4H+=3Fe3++NO↑+2H2O,
步骤5中的反应为6Fe2++Cr2O72—+14H+=6Fe3++2Cr3++7H2O。
若步骤5滴定至终点时消耗K2Cr2O7溶液20.00mL,计算液态产品中NO3-的含量(单位g·L-1,最后结果保留一位小数,写出计算过程)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐等具有强氧化性,溶液pH越小氧化性越强,可用于除去废水中的氨氮、重金属等。
(1)用Na2O2与FeSO4干法制备Na2FeO4的反应历程中包含的热化学方程式有:
2FeSO4(s)+ Na2O2(s) = Fe2O3(s)+Na2SO4(s)+SO3(g) ![]() H1=akJ·mol-1
H1=akJ·mol-1
2 Fe2O3(s)+2 Na2O2(s) =4NaFeO2(s)+ O2(g) ![]() H2=bkJ·mol-1
H2=bkJ·mol-1
2SO3(g) +2Na2O2(s) =2Na2SO4(s)+ O2(g) ![]() H3=ckJ·mol-1
H3=ckJ·mol-1
2NaFeO2(s)+3Na2O2(s) =2Na2FeO4(s)+2Na2O(s) ![]() H4=dkJ·mol-1
H4=dkJ·mol-1
则反应2FeSO4(s) + 6Na2O2(s) =2Na2FeO4(s)+2Na2O(s)+2Na2SO4(s) + O2(g)的![]() H=_____kJ·mol-1(用含a、b、c、d的代数式表示);该反应中,每生成1mol Na2FeO4转移电子数为_____mol。
H=_____kJ·mol-1(用含a、b、c、d的代数式表示);该反应中,每生成1mol Na2FeO4转移电子数为_____mol。
(2)J.C.Poggendor早在1841年利用纯铁作电极插入浓的NaOH溶液电解制得Na2FeO4,阳极生成FeO42-的电极反应式为_____;Deinimger等对其进行改进,在阴、阳电极间设置阳离子交换膜,有效提高了产率,阳离子交换膜的作用是_____。
(3)K2FeO4的稳定性与pH关系如图-1所示,用K2FeO4去除某氨氮(NH3-N)废水,氨氮去除率与pH关系如图-2;用K2FeO4处理Zn2+浓度为0.12mg·L—1的含锌废水{Ksp[Zn(OH)2]=1.2×10-17},锌残留量与pH关系如图-3所示(已知:K2FeO4与H2O反应生成Fe(OH)3的过程中,可以捕集某些难溶金属的氢氧化物形成共沉淀)。
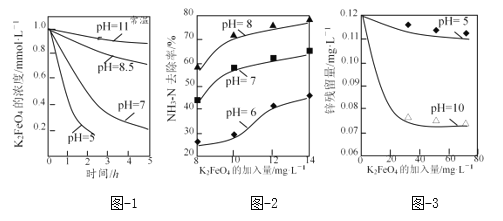
①pH=11时,K2FeO4与H2O反应生成Fe(OH)3和O2等物质的离子方程式为_____。
②图-2中:pH越大氨氮的去除率也越大,其原因可能是_____。
③图-3中:pH=10时锌的去除率比pH=5时大得多,其原因是_____(从锌的存在形态的角度说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温条件下,Al和Fe2O3反应生成Fe和Al2O3。下列说法正确的是
A. 该反应过程中的能量变化如图所示

B. 该反应条件下,Al的还原性强于Fe
C. 反应中每生成1molFe转移3×6.02×1023个电子
D. 实验室进行该反应时常加入KClO3作催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,且四种元素分别位于不同的主族,它们的单质常温下均呈气态。X、Y、W处于不同周期,且在一定条件下其单质能发生反应:X2+Y2→甲,X2+W2→乙,已知,甲、乙常温下均为气态,且两者在空气中相遇时可化合成丙。试回答下列问题:
(1)Y和Z对应的氢化物比较稳定的是:_____________。(填化学式)
(2)化合物丙属于_____晶体(填晶体类型),其水溶液显酸性,用离子方程式表示其原因:___。
(3)X、Z可组成四原子化合物丁,丁中所含的化学键类型为:____________键,请说出化合物丁的一种常见用途:__________________________;
(4)X、Y组成的化合物Y2X4可以与Z2构成清洁高效的燃料电池,若电解质溶液为NaOH溶液,则负极的电极反应式为:__________________________。
(5)一定条件下,取 3.4 g甲气体置于1 L恒容的容器中,4分钟后,容器内的压强变为原来的1.2倍,且不再变化,该反应中甲气体的转化率为:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com