
【题目】Ca(NO2)2(亚硝酸钙)是易溶于水的无色晶体,可用作混凝土中钢筋的防护剂。
(1)Ca(NO2)2的制备方法很多。
①实验室可用反应Ca(NO3)2+2CaFe2O4+4NO![]() 3Ca(NO2)2+2Fe2O3制备Ca(NO2)2,该反应中被氧化的N原子与被还原的N原子的物质的量之比为_____。
3Ca(NO2)2+2Fe2O3制备Ca(NO2)2,该反应中被氧化的N原子与被还原的N原子的物质的量之比为_____。
②用石灰乳吸收硝酸工业尾气中氮氧化物制备Ca(NO2)2,其中NO2与Ca(OH)2反应生成Ca(NO2)2和Ca(NO3)2的化学方程式为_____,经过滤得到含Ca(NO2)2的溶液为液态产品。
(2)测定某液态产品中NO3-含量的步骤如下:
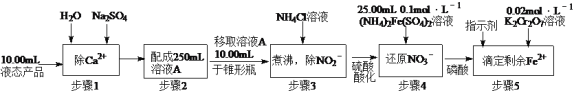
已知:步骤4中的反应为NO3—+3Fe2++4H+=3Fe3++NO↑+2H2O,
步骤5中的反应为6Fe2++Cr2O72—+14H+=6Fe3++2Cr3++7H2O。
若步骤5滴定至终点时消耗K2Cr2O7溶液20.00mL,计算液态产品中NO3-的含量(单位g·L-1,最后结果保留一位小数,写出计算过程)___________。
【答案】2∶1 4NO2 + 2Ca(OH)2=Ca(NO3)2+Ca(NO2)2+2H2O 与K2Cr2O7反应的n(Fe2+)=6n(K2Cr2O7)=6×0.0200mol·L-1×20.00mL×10-3L·mL-1=2.400×10-3mol,与NO3-反应的n(Fe2+)=0.1000 mol·L-1×25.00mL×10-3L·mL-1-2.400×10-3mol=1.000×10-4mol,NO3-的含量为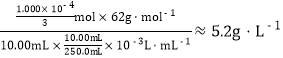
【解析】
(1)①Ca(NO3)2中N为+5价,NO中N为+2价,Ca(NO2)2中N为+3价,即Ca(NO3)2为氧化剂,NO为还原剂,被氧化的N原子与被还原的N原子的物质的量为之比为4:2=2:1;
②NO2与Ca(OH)2反应生成Ca(NO2)2和Ca(NO3)2,即该反应方程式为NO2+Ca(OH)2→Ca(NO3)2+Ca(NO2)2+H2O,NO2在该反应既是氧化剂又是还原剂,利用化合价升降法进行配平,即4NO2 + 2Ca(OH)2=Ca(NO3)2+Ca(NO2)2+2H2O;
(2)与K2Cr2O7反应的n(Fe2+)=6n(K2Cr2O7)=6×0.0200mol·L-1×20.00mL×10-3L·mL-1=2.400×10-3mol,与NO3-反应的n(Fe2+)=0.1000 mol·L-1×25.00mL×10-3L·mL-1-2.400×10-3mol=1.000×10-4mol,则原溶液中m(NO3-)=1.000×10-4mol×62g·mol-1×250mL/(3×10mL),根据流程液态产品的体积为10.00×10-3L,即NO3-的含量为5.2g·L-1;


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】为了研究Mg(OH)2溶于铵盐溶液的原因,进行如下实验:
①向2mL 0.2mol/LMgCl2溶液中滴加1mol/LNaOH溶液至不再产生沉淀,将浊液分为2等份。
②向一份中逐滴加入4mol/L NH4Cl溶液,另一份中逐滴加入4mol/L CH3COONH4溶液(pH≈7),边滴加边测定其中沉淀的量,沉淀的量与铵盐溶液的体积的关系如图。
③将①中的NaOH溶液用氨水替换,重复上述实验。
下列说法不正确的是
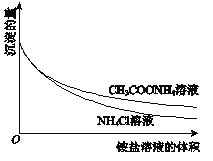
A. Mg(OH)2浊液中存在:Mg(OH)2(s)![]() Mg2+(aq)+2OH﹣(aq)
Mg2+(aq)+2OH﹣(aq)
B. ②中两组实验中均存在反应:Mg(OH)2+2NH4+=Mg2++2NH3H2O
C. H+可能参与了NH4Cl溶液溶解Mg(OH)2的过程
D. ③中获得的图象与②相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表中前四周期的元素,其原子序数依次增大,A为元素周期表中原子半径最小的元素,B的基态原子中占有电子的3个能级上的电子数均相等,D与B同族,C与B同周期,且C的所有p轨道上的电子数与所有s轨道上的电子数相等,E的次外层电子数是其最外层电子的7倍。
回答下列问题:
(1)B、C、D三种元素的电负性由小到大的顺序为___________;(用元素符号表示),D元素基态原子价层电子排布式为______________________;
(2)A、C形成的三原子分子中,C原子的杂化方式为___________;
(3)C、D形成的化合物的晶体类型为___________;
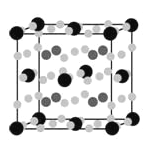
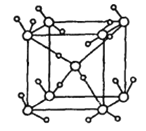
(4)金属Mg与A、E形成的化合物是目前人类已发现的体积储氢密度最高的储氢材料之一,其晶胞结构如图所示,其中黑球代表E,灰球代表Mg,白球代表A,其中白球除在棱上、面上以外,在晶胞内部还有6个。试写出该化合物的化学式:______________________。
(5)B、C、E能形成如图所示三角双锥构型的配合物分子,三种元素的原子分别用大白球、小白球和黑球代表。
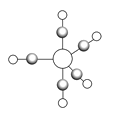
该配合物形成配位键时提供空轨道的原子是___________(填元素符号),该配合物中大白球代表的元素的化合价为___________。
①在水溶液中,水以多种微粒的形式与其他化合物形成水合物。试画出如下微粒的结构图式。H5O2+:______________________
②如图为冰的一种骨架形式,依此为单位向空间延伸该冰中的每个水分子有___________个氢键;如果不考虑晶体和键的类型,哪一物质的空间连接方式与这种冰的连接类似______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若平衡体系A+B![]() C+D,增大压强时反应速率变化如图所示。则下列关于各物质状态的说法正确的是( )
C+D,增大压强时反应速率变化如图所示。则下列关于各物质状态的说法正确的是( )

A.A、B、C、D都是气体
B.C、D都是气体,A、B中有一种是气体
C.A、B都不是气体,C、D中有一种是气体
D.A、B都是气体,C、D中有一种是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以SO2、软锰矿(主要成分MnO2,少量Fe、Al、Ca及Pb的化合物等)、氨水及净化剂等为原料可制备MnSO4溶液和Mn3O4,主要实验步骤如下:
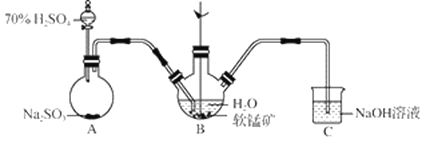
步骤Ⅰ:如图所示装置,将SO2通入B中的软锰矿浆液中(MnO2+SO2 = MnSO4)。
步骤Ⅱ:充分反应后,在不断搅拌下依次向三口烧瓶中加入适量纯净的MnO2、MnCO3,最后加入适量Na2S沉铅等重金属。
步骤Ⅲ:过滤得MnSO4溶液。
(1)装置A用于制取SO2,反应的化学方程式为_____。
(2)装置B中反应应控制在90~100℃,适宜的加热方式是_____。
(3)装置C的作用是_____。
(4)“步骤Ⅱ”中加入纯净MnO2的目的是_____,用MnCO3调节溶液pH时,需调节溶液pH范围为_____(该实验条件下,部分金属离子开始沉淀和沉淀完全的pH如下)。
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
开始沉淀pH | 7.04 | 1.87 | 3.32 | 7.56 |
沉淀完全pH | 9.18 | 3.27 | 4.9 | 10.2 |
(5)已知:①用空气氧化Mn(OH)2浊液可制备Mn3O4[6Mn(OH)2+O2![]() 2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
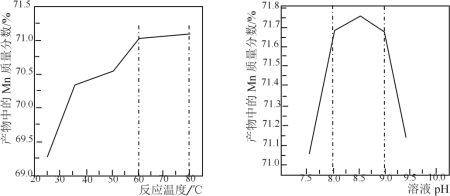
②反应温度超过80℃时,Mn3O4产率开始降低。
③Mn(OH)2是白色沉淀,Mn3O4呈黑色;Mn3O4、MnOOH中锰的质量分数理论值依次为72.03%、62.5%。
请补充完整由步骤Ⅲ得到的MnSO4溶液,并用氨水等制备较纯净的Mn3O4的实验方案:_____,真空干燥6小时得产品Mn3O4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人造地球卫星用到的一种高能电池——银锌蓄电池,其电池的电极反应式为Zn+2OH--2e-→ZnO+H2O,Ag2O+H2O+2e-→2Ag+2OH-。据此判断锌是( )
A.负极,并被氧化B.正极,并被还原
C.负极,并被还原D.正极,并被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭的容器中充入2molA和1molB发生反应:2A(g)+B(g)![]() xC(g),达到平衡后,C的体积分数为w%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mo1充入容器,达到平衡后,C的体积分数仍为w%,则x的值为
xC(g),达到平衡后,C的体积分数为w%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mo1充入容器,达到平衡后,C的体积分数仍为w%,则x的值为
A. 2 B. 3 C. 2或3 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. KOH中含有离子键也含有共价键,属于离子化合物
B. HCl中存在离子键,属于离子化合物
C. 含有共价键的化合物一定是共价化合物
D. 阴、阳离子间通过静电引力而形成的化学键叫做离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com