
【题目】高铁酸盐等具有强氧化性,溶液pH越小氧化性越强,可用于除去废水中的氨氮、重金属等。
(1)用Na2O2与FeSO4干法制备Na2FeO4的反应历程中包含的热化学方程式有:
2FeSO4(s)+ Na2O2(s) = Fe2O3(s)+Na2SO4(s)+SO3(g) ![]() H1=akJ·mol-1
H1=akJ·mol-1
2 Fe2O3(s)+2 Na2O2(s) =4NaFeO2(s)+ O2(g) ![]() H2=bkJ·mol-1
H2=bkJ·mol-1
2SO3(g) +2Na2O2(s) =2Na2SO4(s)+ O2(g) ![]() H3=ckJ·mol-1
H3=ckJ·mol-1
2NaFeO2(s)+3Na2O2(s) =2Na2FeO4(s)+2Na2O(s) ![]() H4=dkJ·mol-1
H4=dkJ·mol-1
则反应2FeSO4(s) + 6Na2O2(s) =2Na2FeO4(s)+2Na2O(s)+2Na2SO4(s) + O2(g)的![]() H=_____kJ·mol-1(用含a、b、c、d的代数式表示);该反应中,每生成1mol Na2FeO4转移电子数为_____mol。
H=_____kJ·mol-1(用含a、b、c、d的代数式表示);该反应中,每生成1mol Na2FeO4转移电子数为_____mol。
(2)J.C.Poggendor早在1841年利用纯铁作电极插入浓的NaOH溶液电解制得Na2FeO4,阳极生成FeO42-的电极反应式为_____;Deinimger等对其进行改进,在阴、阳电极间设置阳离子交换膜,有效提高了产率,阳离子交换膜的作用是_____。
(3)K2FeO4的稳定性与pH关系如图-1所示,用K2FeO4去除某氨氮(NH3-N)废水,氨氮去除率与pH关系如图-2;用K2FeO4处理Zn2+浓度为0.12mg·L—1的含锌废水{Ksp[Zn(OH)2]=1.2×10-17},锌残留量与pH关系如图-3所示(已知:K2FeO4与H2O反应生成Fe(OH)3的过程中,可以捕集某些难溶金属的氢氧化物形成共沉淀)。
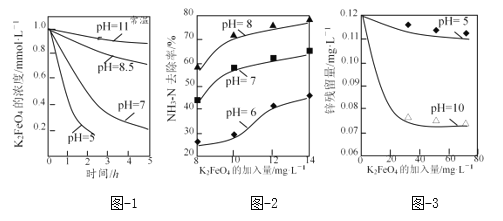
①pH=11时,K2FeO4与H2O反应生成Fe(OH)3和O2等物质的离子方程式为_____。
②图-2中:pH越大氨氮的去除率也越大,其原因可能是_____。
③图-3中:pH=10时锌的去除率比pH=5时大得多,其原因是_____(从锌的存在形态的角度说明)。
【答案】【答题空1】(2a+b+c+2d)/2 【答题空2】5 【答题空3】Fe + 8OH――6e-= FeO42-+4H2O 避免FeO42-在阴极上被还原 【答题空5】4FeO42-+ 10H2O = 4Fe(OH)3↓ + 3O2↑ + 8OH- 【答题空6】高铁酸盐在酸性较强时不稳定,容易分解,与污染物作用的时间短(以及在酸性条件下,氨氮主要以NH4+的形成存在,具有较稳定结约,还原性比NH3弱) 在pH为5时,锌以Zn2+存在;在pH=10时,锌几乎都以Zn(OH)2存在,并被高铁酸盐分解的产物Fe(OH)3捕集
【解析】
(1)①2FeSO4(s)+ Na2O2(s) = Fe2O3(s)+Na2SO4(s)+SO3(g),②2 Fe2O3(s)+2 Na2O2(s) =4NaFeO2(s)+ O2(g),③ 2SO3(g) +2Na2O2(s) =2Na2SO4(s)+ O2(g),④ 2NaFeO2(s)+3Na2O2(s) =2Na2FeO4(s)+2Na2O(s),根据目标反应方程式,(2×①+②+③+2×④)/2,推出△H=(2a+b+c+2d)/2kJ·mol-1;根据反应方程式,FeSO4中Fe的化合价升高,部分Na2O2中的O化合价升高,因此生成1molNa2FeO4转移电子物质的量(1mol×4+1/2mol×2×1)=5mol;
(2)根据电解原理,以及实验目的,Fe作阳极,电解质为NaOH,因此阳极反应式为Fe-6e-+8OH-=FeO42-+4H2O;阳离子交换膜只允许阳离子通过,FeO42-具有强氧化性,在阴极上得电子,因此阳离子交换膜的作用是防止FeO42-在阴极上被还原;
(3)①K2FeO4与H2O反应生成Fe(OH)3和O2,溶液pH=11为碱性,其离子方程式为4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-;
②高铁酸盐具有强氧化性,可用于除去废水中的氨氮,根据信息,高铁酸盐在酸性和中性条件下不稳定,在碱性条件下稳定,因此pH越大氨氮的去除率也越大的原因可能是高铁酸盐在酸性较强时不稳定,容易分解,与污染物作用的时间较短,或者是在酸性条件下,氨氮主要以NH4+形式存在,具有较稳定结果,还原性比NH3弱;
③K2FeO4与H2O反应生成Fe(OH)3的过程中,可以捕集某些难溶金属的氢氧化物形成共沉淀,pH=10时锌的去除率比pH=5时大得多,其原因是在pH为5时,锌以Zn2+存在;在pH=10时,锌几乎都以Zn(OH)2存在,并被高铁酸盐分解的产物Fe(OH)3捕集;


科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g) ![]() 2XY3(g) △H=-92.6 kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
2XY3(g) △H=-92.6 kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量变化的数值 | ||
X2 | Y2 | XY3 | ||
① | 1 | 3 | 0 | 23.15 kJ |
② | 0.6 | 1.8 | 0.8 | Q(Q>0)kJ |
下列叙述正确的是
A. 容器①、②中反应的平衡常数不相等
B. 达平衡时,两个容器中XY3的物质的量浓度均为2mol·L-1
C. 容器②中反应达到平衡时放出的热量为Q kJ
D. 若容器①体积为 0.20 L,则达平衡时放出的热量大于23.15 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是

A. 反应物分子(或离子)间的每次碰撞是反应的先决条件
B. 反应物的分子的每次碰撞都能发生化学反应
C. 活化分子具有比普通分子更高的能量
D. 活化能是活化分子的能量与分子平均能量之差,如图所示正反应的活化能为E-E1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的流程如下:

下列说法错误的是
A. 向大气中排放SO2可能导致酸雨发生
B. 中和器中发生反应的离子方程式为HSO3-+OH-=SO32-+H2O
C. 进入离心机的分散系是悬浊液
D. 检验Na2SO3成品中是否含Na2SO4,可选用稀盐酸和Ba(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人造地球卫星用到的一种高能电池——银锌蓄电池,其电池的电极反应式为Zn+2OH--2e-→ZnO+H2O,Ag2O+H2O+2e-→2Ag+2OH-。据此判断锌是( )
A.负极,并被氧化B.正极,并被还原
C.负极,并被还原D.正极,并被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质充分反应后过滤,将滤液加热、蒸干至质量不变,最终不能得到纯净物的是( )
A. 向含1 mol Ca(HCO3)2的溶液中加入1 mol Na2O2
B. 向带有氧化膜的铝片中加入盐酸
C. 向漂白粉溶液中通入过量CO2
D. 向含1 mol KAl(SO4)2的溶液中加入2 mol Ba(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列叙述错误的是
A.高纯硅可用于制作光感电池B.铝合金大量用于高铁建设
C.水玻璃不燃不爆可用作耐火材料D.活性炭具有除异味和杀菌作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 常温常压下,8gO2含有4NA个电子
B. 0.2g超重水(T216O)中含有的质子数、中子数和电子数均为0.1NA
C. P4分子的空间构型为正四面体形,因此1molP4分子中含有4NA个共价键
D. 标准状况下,11.2LCCl4中含分子数为0.5 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com