
【题目】下列叙述正确的是
A. 常温常压下,8gO2含有4NA个电子
B. 0.2g超重水(T216O)中含有的质子数、中子数和电子数均为0.1NA
C. P4分子的空间构型为正四面体形,因此1molP4分子中含有4NA个共价键
D. 标准状况下,11.2LCCl4中含分子数为0.5 NA
【答案】A
【解析】
A.8g O2物质的量为![]() =0.25mol,1molO原子含有8mol电子,则8g O2含有的电子的物质的量为4mol,则电子数为4NA,A项正确;
=0.25mol,1molO原子含有8mol电子,则8g O2含有的电子的物质的量为4mol,则电子数为4NA,A项正确;
B.超重水T216O,相对分子质量为22,0.2g超重水物质的量为0.2g÷22g/mol=![]() mol, 1molT216O含有12mol中子、10mol质子、10mol电子,0.2g超重水中所含质子数和电子数均为
mol, 1molT216O含有12mol中子、10mol质子、10mol电子,0.2g超重水中所含质子数和电子数均为![]() NA,中子数为
NA,中子数为![]() N A,B项错误;
N A,B项错误;
C.P4分子的空间构型为正四面体形,所以1molP4分子中含有6NA个共价键,C项错误;
D.CCl4在标准状况下是液体,不能用22.4L/mol计算11.2LCCl4物质的量,D项错误;
本题答案选A。


科目:高中化学 来源: 题型:
【题目】高铁酸盐等具有强氧化性,溶液pH越小氧化性越强,可用于除去废水中的氨氮、重金属等。
(1)用Na2O2与FeSO4干法制备Na2FeO4的反应历程中包含的热化学方程式有:
2FeSO4(s)+ Na2O2(s) = Fe2O3(s)+Na2SO4(s)+SO3(g) ![]() H1=akJ·mol-1
H1=akJ·mol-1
2 Fe2O3(s)+2 Na2O2(s) =4NaFeO2(s)+ O2(g) ![]() H2=bkJ·mol-1
H2=bkJ·mol-1
2SO3(g) +2Na2O2(s) =2Na2SO4(s)+ O2(g) ![]() H3=ckJ·mol-1
H3=ckJ·mol-1
2NaFeO2(s)+3Na2O2(s) =2Na2FeO4(s)+2Na2O(s) ![]() H4=dkJ·mol-1
H4=dkJ·mol-1
则反应2FeSO4(s) + 6Na2O2(s) =2Na2FeO4(s)+2Na2O(s)+2Na2SO4(s) + O2(g)的![]() H=_____kJ·mol-1(用含a、b、c、d的代数式表示);该反应中,每生成1mol Na2FeO4转移电子数为_____mol。
H=_____kJ·mol-1(用含a、b、c、d的代数式表示);该反应中,每生成1mol Na2FeO4转移电子数为_____mol。
(2)J.C.Poggendor早在1841年利用纯铁作电极插入浓的NaOH溶液电解制得Na2FeO4,阳极生成FeO42-的电极反应式为_____;Deinimger等对其进行改进,在阴、阳电极间设置阳离子交换膜,有效提高了产率,阳离子交换膜的作用是_____。
(3)K2FeO4的稳定性与pH关系如图-1所示,用K2FeO4去除某氨氮(NH3-N)废水,氨氮去除率与pH关系如图-2;用K2FeO4处理Zn2+浓度为0.12mg·L—1的含锌废水{Ksp[Zn(OH)2]=1.2×10-17},锌残留量与pH关系如图-3所示(已知:K2FeO4与H2O反应生成Fe(OH)3的过程中,可以捕集某些难溶金属的氢氧化物形成共沉淀)。
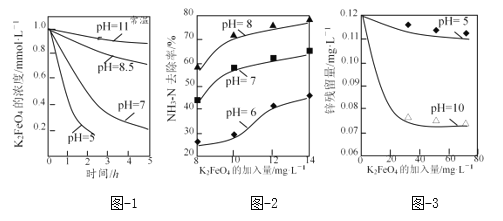
①pH=11时,K2FeO4与H2O反应生成Fe(OH)3和O2等物质的离子方程式为_____。
②图-2中:pH越大氨氮的去除率也越大,其原因可能是_____。
③图-3中:pH=10时锌的去除率比pH=5时大得多,其原因是_____(从锌的存在形态的角度说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,且四种元素分别位于不同的主族,它们的单质常温下均呈气态。X、Y、W处于不同周期,且在一定条件下其单质能发生反应:X2+Y2→甲,X2+W2→乙,已知,甲、乙常温下均为气态,且两者在空气中相遇时可化合成丙。试回答下列问题:
(1)Y和Z对应的氢化物比较稳定的是:_____________。(填化学式)
(2)化合物丙属于_____晶体(填晶体类型),其水溶液显酸性,用离子方程式表示其原因:___。
(3)X、Z可组成四原子化合物丁,丁中所含的化学键类型为:____________键,请说出化合物丁的一种常见用途:__________________________;
(4)X、Y组成的化合物Y2X4可以与Z2构成清洁高效的燃料电池,若电解质溶液为NaOH溶液,则负极的电极反应式为:__________________________。
(5)一定条件下,取 3.4 g甲气体置于1 L恒容的容器中,4分钟后,容器内的压强变为原来的1.2倍,且不再变化,该反应中甲气体的转化率为:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是
A. 溴水中有平衡:Br2+ H2O ![]() HBr+ HBrO,当加入 AgNO3溶液后,溶液颜色变浅
HBr+ HBrO,当加入 AgNO3溶液后,溶液颜色变浅
B. 对CO + NO2 ![]() CO2+ NO,平衡体系增大压强可使颜色变深
CO2+ NO,平衡体系增大压强可使颜色变深
C. 在电解含有酚酞的硫酸钠溶液时,阴极附近溶液的颜色变红
D. 合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡pH随溶液体积变化的曲线如图所示。据图判断不正确的是

A. I是盐酸,Ⅱ是醋酸
B. 溶液的导电性a>b>c
C. a、b、c三点KW的数值相同
D. 稀释前等体积的I、Ⅱ溶液中和氢氧化钠的能力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铋[( BiO)2CO3·0.5H2O]又名碳酸氧铋,高温灼烧时会分解为Bi2O3,其用途包括制备其它铋化合物、分析试剂、制备胃药等,工业生产( BiO)2CO3·0.5H2O的流程如下图所示,请回答下列相关问题。

(1)(BiO)2CO3·0.5H2O中铋的化合价是___________,铋在周期表中的位置是___________。
(2)酸溶过程生成的气体是NO,该反应的离子方程式是______________________。工厂在生产中将NO与适量空气混合后通入水中得到稀硝酸,该操作的优点是___________、___________。
(3)水解过程中为了增大Bi(NO3)3的水解程度,可采用的措施是___________(任写一项)。
(4)过滤得到的(BiO)2CO3·0.5H2O要在烘箱中烘干,烘干时工作人员未控制好关键条件致使产品不纯,导致纯度下降的化学方程式是______________________。
(5)铋的冶炼方法之一是火法炼铋,但得的铋纯度较低,粗铋可通过电解法进行精炼,其原理如下图所示,其中电极a的材料是___________,电极b上发生的电极反应为___________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com