
【题目】下列事实,不能用勒夏特列原理解释的是
A. 溴水中有平衡:Br2+ H2O ![]() HBr+ HBrO,当加入 AgNO3溶液后,溶液颜色变浅
HBr+ HBrO,当加入 AgNO3溶液后,溶液颜色变浅
B. 对CO + NO2 ![]() CO2+ NO,平衡体系增大压强可使颜色变深
CO2+ NO,平衡体系增大压强可使颜色变深
C. 在电解含有酚酞的硫酸钠溶液时,阴极附近溶液的颜色变红
D. 合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施
【答案】B
【解析】
如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,这就是勒夏特列原理的内容,注意对于反应前后体积不变的反应,压强不影响该平衡。
A项、溴水中存在下列平衡Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液时,Br–与Ag+反应生成溴AgBr沉淀,平衡正向移动,Br2浓度减小,溶液颜色变浅,能用勒夏特利原理解释,故A错误;
HBr+HBrO,当加入AgNO3溶液时,Br–与Ag+反应生成溴AgBr沉淀,平衡正向移动,Br2浓度减小,溶液颜色变浅,能用勒夏特利原理解释,故A错误;
B项、反应前后体积不变,缩小体积增大压强,平衡不移动,但物质的浓度会增大,所以颜色加深,不能用勒夏特利原理解释,故B正确;
C项、电解硫酸钠溶液时,溶液中水电离生成氢离子和氢氧根离子,阴极上氢离子放电生成氢气,从而促进水电离,导致溶液中氢氧根离子浓度增大,溶液呈碱性,无色酚酞试液遇碱变红色,可以用勒夏特列原理解释,故C错误;
D项、合成氨反应为放热反应,降低温度平衡正向移动,氨的产率提高,能用勒夏特利原理解释,故D错误。
故选B。


科目:高中化学 来源: 题型:
【题目】利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的流程如下:

下列说法错误的是
A. 向大气中排放SO2可能导致酸雨发生
B. 中和器中发生反应的离子方程式为HSO3-+OH-=SO32-+H2O
C. 进入离心机的分散系是悬浊液
D. 检验Na2SO3成品中是否含Na2SO4,可选用稀盐酸和Ba(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g) + bB(g)![]() xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指( )
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指( )

A.反应物A的百分含量
B.平衡混合气中物质B的百分含量
C.平衡混合气的密度
D.平衡混合气的平均摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I 充满HCl(标准状况)的烧瓶做完喷泉实验后得到的稀盐酸溶液,用标准氢氧化钠溶液滴定,以确定该稀盐酸的准确物质的量浓度。回答下列问题:
(1)该滴定实验盛装标准液的仪器是__________, 若该仪器的量程为50mL,调液面为0,将该仪器中所有液体放出,则放出的溶液体积_______50mL。(填“>”,“=”,“<”)
(2)若该滴定实验用酚酞做指示剂,达到滴定终点时,溶液颜色从____色变为____色且保持30s内不变色。
(3)配制三种不同浓度的标准氢氧化钠溶液,你认为最合适的是第______种。
①5.000 mol/L ②0. 5000 mol/L ③0.0500 mol/L
(4)若采用上述合适的标准氢氧化钠溶液滴定稀盐酸,操作步骤合理,滴定后的实验数据如下:
实验编号 | 待测盐酸的体积(mL) | 滴入氢氧化钠溶液的体积(mL) |
1 | 20.00 | 17.30 |
2 | 20.00 | 17.02 |
3 | 20.00 | 16.98 |
求测得的稀盐酸的物质的量浓度为_________________________。
II 测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol·L-1的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式______________。
(2)判断滴定终点的方法是______。
(3)计算:血液中含钙离子的浓度为____g·mL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:
X(g)+2Y(g)![]() 2Z(g),不能作为反应达到平衡的标志是
2Z(g),不能作为反应达到平衡的标志是
A. 容器内压强不随时间变化 B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为1∶2∶2 D. 单位时间消耗0.1 mol X同时消耗0.2 mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 常温常压下,8gO2含有4NA个电子
B. 0.2g超重水(T216O)中含有的质子数、中子数和电子数均为0.1NA
C. P4分子的空间构型为正四面体形,因此1molP4分子中含有4NA个共价键
D. 标准状况下,11.2LCCl4中含分子数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应N2(g)+3H2(g)![]() 2NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成17 g NH3(g),放出46.1 kJ的热量。
2NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成17 g NH3(g),放出46.1 kJ的热量。

请回答下列问题:
(1)该反应通常用铁作催化剂,加催化剂会使图中E变________(填“大”或“小”),E的大小对该反应的反应热有无影响?_______。理由是____________________________;
(2)图中ΔH=______kJ·mol-1;
(3)起始充入2mol·L-1 N2和5.5 mol·L-1 H2 ,经过50 min,NH3的浓度为1mol·L-1,则v(N2)=_________mol·L-1·min-1、c(H2)=___________mol·L-1;
(4)已知NH3(g)=== NH3 (l) ΔH=-QkJ·mol-1,书写N2(g)+3H2(g)===2NH3 (l)的热化学方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界。请回答下列问题:
(1)以CO2与NH3为原料可合成尿素。已知
①2NH3(g)+CO2(g)=NH2COONH4(s) △H=-159.47 kJ·mol-1
②NH2COONH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.49 kJ·mol-1
③H2O(l)=H2O(g) △H=+88.0 kJ·mol-1
写出NH3和CO2合成尿素和液态水的热化学方程式______________________________。
(2)海洋是地球上碳元素的最大吸收池。
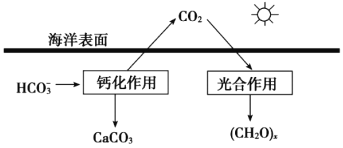
①溶于海水中的CO2主要以四种无机碳形式存在,即:CO2、H2CO3、___________、___________。
②在海洋碳循环中,可通过如图所示的途径固碳。写出钙化作用的离子方程式___________。
(3)常温常压下,空气中的CO2溶于水中达到平衡时,其转化关系如下:
①CO2+H2O![]() H2CO3 K=1.8×10-3
H2CO3 K=1.8×10-3
②H2CO3![]() H++HCO3- Ka1=4.3×10-7,
H++HCO3- Ka1=4.3×10-7,
③HCO3-![]() H++CO32- Ka2=5.6×10-11
H++CO32- Ka2=5.6×10-11
通常情况下,海水的pH约为8,若忽略水的电离及H2CO3的第二级电离,则溶液中c(CO2)=____________________________________________mol/L。(保留两位有效数字)
(4)为了测量某湖水中无机碳含量,量取100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收。用1.0mol/L盐酸滴定吸收液,生成的V(CO2)随V(盐酸)变化关系如图1所示,则吸收液中离子浓度由大到小的顺序为__________,湖水中无机碳的浓度为___________mol/L。
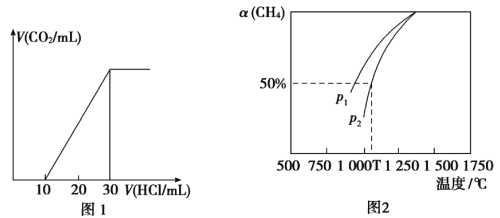
(5)用CO2和天然气可以制备CO和H2,CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。密闭容器中浓度均为0.1mol/L的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2所示,则压强p1___________p2(填“>”或“<)。若p2=3MPa,则T℃时该反应的平衡常数Kp=___________MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
2CO(g)+2H2(g)。密闭容器中浓度均为0.1mol/L的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2所示,则压强p1___________p2(填“>”或“<)。若p2=3MPa,则T℃时该反应的平衡常数Kp=___________MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A. 反应前2 min的平均速率v(Z)=2.0×10-3 mol·(L·min)-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com