
【题目】下列分子中,中子总数为 23 的是
A.18O3B.2H217O2C.14N16O2D.14C16O2
 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列叙述错误的是
A.高纯硅可用于制作光感电池B.铝合金大量用于高铁建设
C.水玻璃不燃不爆可用作耐火材料D.活性炭具有除异味和杀菌作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 常温常压下,8gO2含有4NA个电子
B. 0.2g超重水(T216O)中含有的质子数、中子数和电子数均为0.1NA
C. P4分子的空间构型为正四面体形,因此1molP4分子中含有4NA个共价键
D. 标准状况下,11.2LCCl4中含分子数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定条件下,在水的电离平衡中,c(H+)和c(OH-)的关系如下图所示。100 ℃时,若盐酸中c(H+)=5×10-4 mol·L-1,则由水电离产生的c(H+)=__________。

(2)pH=3的盐酸与pH=5的盐酸等体积混合,pH=_________。
(3)25℃时,在0.5L0.2mol/L的HA溶液中,有0.02mol的HA电离成离子,则该温度下的电离常数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界。请回答下列问题:
(1)以CO2与NH3为原料可合成尿素。已知
①2NH3(g)+CO2(g)=NH2COONH4(s) △H=-159.47 kJ·mol-1
②NH2COONH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.49 kJ·mol-1
③H2O(l)=H2O(g) △H=+88.0 kJ·mol-1
写出NH3和CO2合成尿素和液态水的热化学方程式______________________________。
(2)海洋是地球上碳元素的最大吸收池。
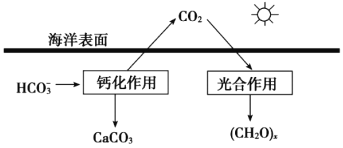
①溶于海水中的CO2主要以四种无机碳形式存在,即:CO2、H2CO3、___________、___________。
②在海洋碳循环中,可通过如图所示的途径固碳。写出钙化作用的离子方程式___________。
(3)常温常压下,空气中的CO2溶于水中达到平衡时,其转化关系如下:
①CO2+H2O![]() H2CO3 K=1.8×10-3
H2CO3 K=1.8×10-3
②H2CO3![]() H++HCO3- Ka1=4.3×10-7,
H++HCO3- Ka1=4.3×10-7,
③HCO3-![]() H++CO32- Ka2=5.6×10-11
H++CO32- Ka2=5.6×10-11
通常情况下,海水的pH约为8,若忽略水的电离及H2CO3的第二级电离,则溶液中c(CO2)=____________________________________________mol/L。(保留两位有效数字)
(4)为了测量某湖水中无机碳含量,量取100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收。用1.0mol/L盐酸滴定吸收液,生成的V(CO2)随V(盐酸)变化关系如图1所示,则吸收液中离子浓度由大到小的顺序为__________,湖水中无机碳的浓度为___________mol/L。
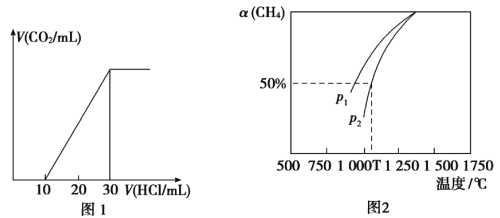
(5)用CO2和天然气可以制备CO和H2,CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。密闭容器中浓度均为0.1mol/L的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2所示,则压强p1___________p2(填“>”或“<)。若p2=3MPa,则T℃时该反应的平衡常数Kp=___________MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
2CO(g)+2H2(g)。密闭容器中浓度均为0.1mol/L的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2所示,则压强p1___________p2(填“>”或“<)。若p2=3MPa,则T℃时该反应的平衡常数Kp=___________MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
①伴有能量变化的物质变化都是化学变化 ②物质发生化学反应都伴随能量变化
③所有的氧化还原反应都是放热反应 ④所有的燃烧反应都是放热反应
⑤需要加热才能发生的的反应一定是吸热反应 ⑥放热反应在常温下均很容易进行
A. ①②④⑤ B. ②④ C. ②③④ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年10月15日,中国用“长征三号乙”运载火箭成功以“一箭双星”方式发射北斗三号全球组网卫星系统第15、16号卫星,其火箭推进剂为高氯酸铵(NH4ClO4)等。制备NH4ClO4的工艺流程如下:
饱和食盐水![]() NaClO3
NaClO3![]() NaClO4
NaClO4![]() NaClO4
NaClO4![]() NH4ClO4
NH4ClO4
下列说法错误的是
A. NH4ClO4属于离子化合物
B. 溶解度:NaClO4>NH4ClO4
C. 电解NaClO3溶液时阳极反应式为ClO3-+H2O-2e-=C1O4-+2H+
D. 该流程中可循环利用的物质是NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、S和Cl元素的单质及化合物在工业生产中的有效利用备受关注。请回答下列问题:
(1)已知:I.2SO2(g)+O2(g)+2H2O(1) =2H2SO4(aq) △H1;
Ⅱ.Cl2(g)+H2O(1)![]() HCl(aq)+HClO(aq) △H2;
HCl(aq)+HClO(aq) △H2;
Ⅲ.2HClO(aq) =2HCl(aq)+O2(g) △H3
SO2(g)+Cl2(g)+2H2O(1)=2HCl(aq)+H2SO4 (aq) △H4=__________(用含有△H1、△H2和△H3的代数式表示)。
(2)25℃时,H2SO3溶液中各含硫微粒的物质的量分数(δ)与溶液pH的变化关系如图所示。

已知25℃时,NaHSO3的水溶液pH<7,用图中的数据通过计算解释原因 ____________________。
(3)利用“ Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“ Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:

①放电时,正极的电极反应式为______。
②选用高氯酸钠—四甘醇二甲醚做电解液的优点是_______(至少写两点)。
(4)氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂。
①一氯胺(NH2Cl)的电子式为_______。一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生水解,生成具有强烈杀菌作用的物质,该反应的化学方程式为_______。
②在恒温条件下,2molCl2和1molNH3发生反应2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:

计算C点时该反应的压强平衡常数Kp(C)= _______ (Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 用浓盐酸分别和MnO2、KClO3反应制备1mol氯气,转移的电子数均为2NA
B. 将1molCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA
C. 常温下,1L pH=2的H2SO4溶液中,硫酸和水电离的H+总数为0.01NA
D. 常温常压下,NO2与N2O4的混合气体46g,原子总数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com