
【题目】化学与生活密切相关。下列叙述错误的是
A.高纯硅可用于制作光感电池B.铝合金大量用于高铁建设
C.水玻璃不燃不爆可用作耐火材料D.活性炭具有除异味和杀菌作用
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等。可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得。工艺流程如下图:
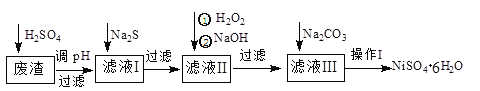
请回答下列问题:
(1)用稀硫酸溶解废渣时,为了提高浸取率可采取的措施有_________________(任写一点)。
(2)向滤液中滴入适量的Na2S溶液,目的是除去Cu2+、Zn2+,写出除去Cu2+的离子方程式:____________________________________________。
(3)在40℃左右,用6%的H2O2氧化Fe2+,再在95℃时加入NaOH调节pH,除去铁和铬。此外,还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。如图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域[已知25℃时,Fe(OH)3的Ksp=2.64×10-39]。
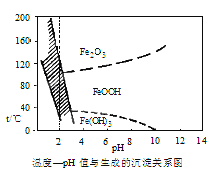
下列说法正确的是(选填序号)_______。
a. FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.6×10-29mol·L-1
c.用氯酸钠在酸性条件下氧化Fe2+的离子方程式为6Fe2++C1O3-+6H+=6Fe3++C1-+3H2O
d.工业生产中常保持在85~95℃生成黄铁钒钠,此时水体的pH约为3
(4)上述流程中滤液I的主要成分是___________。
(5)操作I的实验步骤依次为(实验中可选用的试剂:6mol·L-1的H2SO4溶液、蒸馏水、pH试纸):
①___________;②___________;③蒸发浓缩、冷却结晶,过滤得NiSO4·6H2O晶体:④用少量乙醇洗涤NiSO4·6H2O晶体并晾干。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐等具有强氧化性,溶液pH越小氧化性越强,可用于除去废水中的氨氮、重金属等。
(1)用Na2O2与FeSO4干法制备Na2FeO4的反应历程中包含的热化学方程式有:
2FeSO4(s)+ Na2O2(s) = Fe2O3(s)+Na2SO4(s)+SO3(g) ![]() H1=akJ·mol-1
H1=akJ·mol-1
2 Fe2O3(s)+2 Na2O2(s) =4NaFeO2(s)+ O2(g) ![]() H2=bkJ·mol-1
H2=bkJ·mol-1
2SO3(g) +2Na2O2(s) =2Na2SO4(s)+ O2(g) ![]() H3=ckJ·mol-1
H3=ckJ·mol-1
2NaFeO2(s)+3Na2O2(s) =2Na2FeO4(s)+2Na2O(s) ![]() H4=dkJ·mol-1
H4=dkJ·mol-1
则反应2FeSO4(s) + 6Na2O2(s) =2Na2FeO4(s)+2Na2O(s)+2Na2SO4(s) + O2(g)的![]() H=_____kJ·mol-1(用含a、b、c、d的代数式表示);该反应中,每生成1mol Na2FeO4转移电子数为_____mol。
H=_____kJ·mol-1(用含a、b、c、d的代数式表示);该反应中,每生成1mol Na2FeO4转移电子数为_____mol。
(2)J.C.Poggendor早在1841年利用纯铁作电极插入浓的NaOH溶液电解制得Na2FeO4,阳极生成FeO42-的电极反应式为_____;Deinimger等对其进行改进,在阴、阳电极间设置阳离子交换膜,有效提高了产率,阳离子交换膜的作用是_____。
(3)K2FeO4的稳定性与pH关系如图-1所示,用K2FeO4去除某氨氮(NH3-N)废水,氨氮去除率与pH关系如图-2;用K2FeO4处理Zn2+浓度为0.12mg·L—1的含锌废水{Ksp[Zn(OH)2]=1.2×10-17},锌残留量与pH关系如图-3所示(已知:K2FeO4与H2O反应生成Fe(OH)3的过程中,可以捕集某些难溶金属的氢氧化物形成共沉淀)。
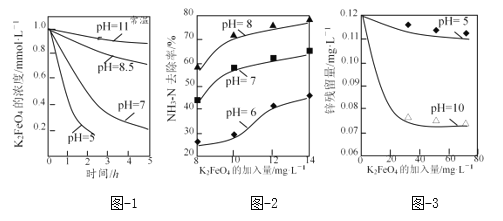
①pH=11时,K2FeO4与H2O反应生成Fe(OH)3和O2等物质的离子方程式为_____。
②图-2中:pH越大氨氮的去除率也越大,其原因可能是_____。
③图-3中:pH=10时锌的去除率比pH=5时大得多,其原因是_____(从锌的存在形态的角度说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温条件下,Al和Fe2O3反应生成Fe和Al2O3。下列说法正确的是
A. 该反应过程中的能量变化如图所示

B. 该反应条件下,Al的还原性强于Fe
C. 反应中每生成1molFe转移3×6.02×1023个电子
D. 实验室进行该反应时常加入KClO3作催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaSO4)=9×10-6,常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断错误的是

A. a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液
B. a点对应的Ksp等于c点对应的Ksp
C. b点将有沉淀生成,平衡后溶液中c(SO42-)一定不等于3×10-3molL-1
D. 向d点溶液中加入适量CaCl2固体可以变到c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO合成甲醇(CH3OH)的化学反应方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH < 0。按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
CH3OH(g) ΔH < 0。按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是

A. 正反应速率:v(a)>v(c) v(b)>v(d)
B. 平衡时a点一定有n(CO):n(H2)=1:2
C. 平衡常数:K(a)>K(c) K(b)=K(d)
D. 平均摩尔质量:![]() (a)<
(a)<![]() (c)
(c)![]() (b)>
(b)>![]() (d)
(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,且四种元素分别位于不同的主族,它们的单质常温下均呈气态。X、Y、W处于不同周期,且在一定条件下其单质能发生反应:X2+Y2→甲,X2+W2→乙,已知,甲、乙常温下均为气态,且两者在空气中相遇时可化合成丙。试回答下列问题:
(1)Y和Z对应的氢化物比较稳定的是:_____________。(填化学式)
(2)化合物丙属于_____晶体(填晶体类型),其水溶液显酸性,用离子方程式表示其原因:___。
(3)X、Z可组成四原子化合物丁,丁中所含的化学键类型为:____________键,请说出化合物丁的一种常见用途:__________________________;
(4)X、Y组成的化合物Y2X4可以与Z2构成清洁高效的燃料电池,若电解质溶液为NaOH溶液,则负极的电极反应式为:__________________________。
(5)一定条件下,取 3.4 g甲气体置于1 L恒容的容器中,4分钟后,容器内的压强变为原来的1.2倍,且不再变化,该反应中甲气体的转化率为:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com