
【题目】下列变化中,反应物的总能量小于生成物的总能量的是
A. 甲烷燃烧B. 铝热反应C. 碳酸钙分解D. 酸碱中和
 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质充分反应后过滤,将滤液加热、蒸干至质量不变,最终不能得到纯净物的是( )
A. 向含1 mol Ca(HCO3)2的溶液中加入1 mol Na2O2
B. 向带有氧化膜的铝片中加入盐酸
C. 向漂白粉溶液中通入过量CO2
D. 向含1 mol KAl(SO4)2的溶液中加入2 mol Ba(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I 充满HCl(标准状况)的烧瓶做完喷泉实验后得到的稀盐酸溶液,用标准氢氧化钠溶液滴定,以确定该稀盐酸的准确物质的量浓度。回答下列问题:
(1)该滴定实验盛装标准液的仪器是__________, 若该仪器的量程为50mL,调液面为0,将该仪器中所有液体放出,则放出的溶液体积_______50mL。(填“>”,“=”,“<”)
(2)若该滴定实验用酚酞做指示剂,达到滴定终点时,溶液颜色从____色变为____色且保持30s内不变色。
(3)配制三种不同浓度的标准氢氧化钠溶液,你认为最合适的是第______种。
①5.000 mol/L ②0. 5000 mol/L ③0.0500 mol/L
(4)若采用上述合适的标准氢氧化钠溶液滴定稀盐酸,操作步骤合理,滴定后的实验数据如下:
实验编号 | 待测盐酸的体积(mL) | 滴入氢氧化钠溶液的体积(mL) |
1 | 20.00 | 17.30 |
2 | 20.00 | 17.02 |
3 | 20.00 | 16.98 |
求测得的稀盐酸的物质的量浓度为_________________________。
II 测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol·L-1的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式______________。
(2)判断滴定终点的方法是______。
(3)计算:血液中含钙离子的浓度为____g·mL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 常温常压下,8gO2含有4NA个电子
B. 0.2g超重水(T216O)中含有的质子数、中子数和电子数均为0.1NA
C. P4分子的空间构型为正四面体形,因此1molP4分子中含有4NA个共价键
D. 标准状况下,11.2LCCl4中含分子数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应N2(g)+3H2(g)![]() 2NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成17 g NH3(g),放出46.1 kJ的热量。
2NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成17 g NH3(g),放出46.1 kJ的热量。

请回答下列问题:
(1)该反应通常用铁作催化剂,加催化剂会使图中E变________(填“大”或“小”),E的大小对该反应的反应热有无影响?_______。理由是____________________________;
(2)图中ΔH=______kJ·mol-1;
(3)起始充入2mol·L-1 N2和5.5 mol·L-1 H2 ,经过50 min,NH3的浓度为1mol·L-1,则v(N2)=_________mol·L-1·min-1、c(H2)=___________mol·L-1;
(4)已知NH3(g)=== NH3 (l) ΔH=-QkJ·mol-1,书写N2(g)+3H2(g)===2NH3 (l)的热化学方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定条件下,在水的电离平衡中,c(H+)和c(OH-)的关系如下图所示。100 ℃时,若盐酸中c(H+)=5×10-4 mol·L-1,则由水电离产生的c(H+)=__________。

(2)pH=3的盐酸与pH=5的盐酸等体积混合,pH=_________。
(3)25℃时,在0.5L0.2mol/L的HA溶液中,有0.02mol的HA电离成离子,则该温度下的电离常数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界。请回答下列问题:
(1)以CO2与NH3为原料可合成尿素。已知
①2NH3(g)+CO2(g)=NH2COONH4(s) △H=-159.47 kJ·mol-1
②NH2COONH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.49 kJ·mol-1
③H2O(l)=H2O(g) △H=+88.0 kJ·mol-1
写出NH3和CO2合成尿素和液态水的热化学方程式______________________________。
(2)海洋是地球上碳元素的最大吸收池。
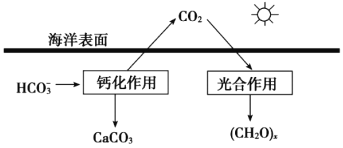
①溶于海水中的CO2主要以四种无机碳形式存在,即:CO2、H2CO3、___________、___________。
②在海洋碳循环中,可通过如图所示的途径固碳。写出钙化作用的离子方程式___________。
(3)常温常压下,空气中的CO2溶于水中达到平衡时,其转化关系如下:
①CO2+H2O![]() H2CO3 K=1.8×10-3
H2CO3 K=1.8×10-3
②H2CO3![]() H++HCO3- Ka1=4.3×10-7,
H++HCO3- Ka1=4.3×10-7,
③HCO3-![]() H++CO32- Ka2=5.6×10-11
H++CO32- Ka2=5.6×10-11
通常情况下,海水的pH约为8,若忽略水的电离及H2CO3的第二级电离,则溶液中c(CO2)=____________________________________________mol/L。(保留两位有效数字)
(4)为了测量某湖水中无机碳含量,量取100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收。用1.0mol/L盐酸滴定吸收液,生成的V(CO2)随V(盐酸)变化关系如图1所示,则吸收液中离子浓度由大到小的顺序为__________,湖水中无机碳的浓度为___________mol/L。
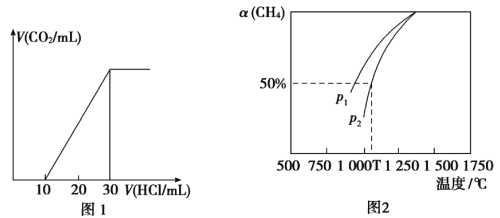
(5)用CO2和天然气可以制备CO和H2,CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。密闭容器中浓度均为0.1mol/L的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2所示,则压强p1___________p2(填“>”或“<)。若p2=3MPa,则T℃时该反应的平衡常数Kp=___________MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
2CO(g)+2H2(g)。密闭容器中浓度均为0.1mol/L的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2所示,则压强p1___________p2(填“>”或“<)。若p2=3MPa,则T℃时该反应的平衡常数Kp=___________MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年10月15日,中国用“长征三号乙”运载火箭成功以“一箭双星”方式发射北斗三号全球组网卫星系统第15、16号卫星,其火箭推进剂为高氯酸铵(NH4ClO4)等。制备NH4ClO4的工艺流程如下:
饱和食盐水![]() NaClO3
NaClO3![]() NaClO4
NaClO4![]() NaClO4
NaClO4![]() NH4ClO4
NH4ClO4
下列说法错误的是
A. NH4ClO4属于离子化合物
B. 溶解度:NaClO4>NH4ClO4
C. 电解NaClO3溶液时阳极反应式为ClO3-+H2O-2e-=C1O4-+2H+
D. 该流程中可循环利用的物质是NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g)。ΔH
CH3OH(g)。ΔH
(1)平衡常数表达式为K=_______。
(2)下图是该反应在不同温度下CO的转化率随时间变化的曲线。

① 该反应的焓变ΔH________0(填“>”、“<”或“=”)。
② T1和T2温度下的平衡常数大小关系是K1_______K2(填“>”、“<”或“=”)。
③ 若容器容积不变,下列措施可增加甲醇产率的是_______。
a. 升高温度 b. 将CH3OH(g)从体系中分离
c. 使用合适的催化剂 d. 充入He,使体系总压强增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com