
【题目】实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是
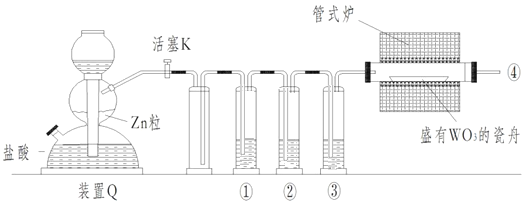
A.①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C.结束反应时,先关闭活塞K,再停止加热
D.装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之和与L层的电子数相同.下列判断不正确的是( )
A. 乙元素的族序数比甲元素的族序数大
B. 甲、丙两元素最高价氧化物对应水化物的酸性强弱:甲<丙
C. 原子半径的大小:甲>乙
D. 含乙元素的化合物数目比含甲或丙元素的化合物数目多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、技术密切关。下列说法错误的是
A. “疫苗”等生物制剂需要冷冻保存 B. 明矾和二氧化氯处理水,原理相同
C. 用氢氟酸可进行玻璃雕刻 D. 小苏打和氢氧化铝均可用于中和胃酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有ag某气体,它由双原子分子构成,它的摩尔质量为Mg/mol。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为_________mol。
(2)该气体所含原子总数为_____________个。
(3)该气体在标准状况下的体积为___________L。
(4)该气体溶于1 L水中(不考虑反应),其溶液中溶质的质量分数为_____________。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为___________mol/L。
(6)下列所含分子数由多到少的排列顺序是____________(填写序号)。
A.标准状况下33. 6 L H2 B.所含电子的物质的量为4 mol的H2
C. 4℃时45 g H2O D.常温下,16gO2与14gN2的混合气体
E.含原子总数约为1.204×1024的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 硫酸钙悬浊液中加入碳酸钠:CaSO4(s) + CO32-(aq)=CaCO3(s) + SO42-(aq)
B. 醋酸铵溶于水:CH3COONH4+ H2O![]() CH3COOH + NH3·H2O
CH3COOH + NH3·H2O
C. 硫酸氢钠溶液中滴入氢氧化钡溶液呈中性:HSO4-+ OH-=SO42-+ H2O
D. 碳酸氢钠水解:HCO3-+ H2O![]() H3O++ CO32-
H3O++ CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:3H2(g)+N2(g)![]() 2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下∶
2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下∶
容器 | 甲 | 乙 | 丙 |
反应物的投入量 | 3 molH2、2 molN2 | 6 molH2、4 molN2 | 2 molNH3 |
达到平衡的时间/min | 5 | 8 | |
平衡时N2的浓度/ mol·L-1 | c1 | 1.5 | |
NH3的体积分数 | φ1 | φ2 | |
混合气体的密度/g·L-1 | ρ1 | ρ2 |
下列说法不正确的是
A.容器乙中反应从开始到达平衡的反应速率为v(H2)=0.3mol·L-1·min-1
B.在该温度下甲容器中反应的平衡常数K=![]()
C.2c1<1.5
D.2ρ1=ρ2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下图为相互串联的三个装置,试回答:
![]()

(1)若利用乙池在铁片上镀银,则B是_________(填电极材料),电极反应式是_________;应选用的电解质溶液是_____________。
(2)若利用乙池进行粗铜的电解精炼,则________极(填“A”或“B”)是粗铜,若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为_____________________。
(3)丙池滴入少量酚酞试液,电解一段时间___________(填“C”或“Fe”)极附近呈红色。
(4)写出甲池负极的电极反应式:________________________________。若甲池消耗3.2gCH3OH气体,则丙池中阳极上放出的气体物质的量为______________。
II.(5)请利用反应Fe +2Fe3+= 3Fe2+设计原电池。
设计要求:①该装置尽可能提高化学能转化为电能的效率;
②材料及电解质溶液自选,在图中做必要标注;
③画出电子的转移方向。____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了避免青铜器生成铜绿,以下方法正确的是 ( )
A.将青铜器放在银质托盘上B.将青铜器与直流电源的正极相连
C.将青铜器保存在潮湿的空气中D.在青铜器的表面覆盖一层防渗的高分子膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4,。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。
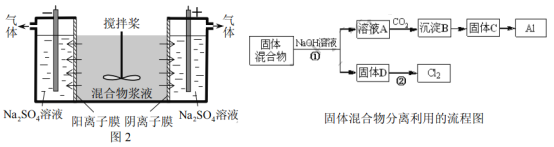
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________。B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化,加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,![]() 能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com