
����Ŀ����14�֣�ij����ャҺ����Al(OH)3��MnO2������Na2CrO4,�����ǵ��������������ʹNa2CrO4������ȫ��ˮ������ij�о�С��������Ƶĵ�����װ�ã���ͼ2����ʹ��Һ����ɹ�������ͺ���Ԫ����Һ�����������á��ش��������е����⡣
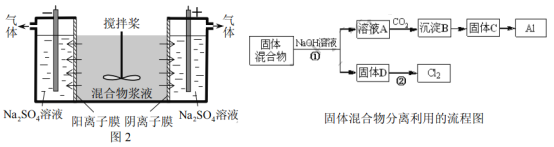
������������ķ�������ã�����ͼ�еIJ��ַ�������ͷ�Ӧ����δ������
��1����Ӧ�������Լ�NaOH�ĵ���ʽΪ_________��B��C�ķ�Ӧ����Ϊ__________��C��Al���Ʊ�������Ϊ______________��
��2����С��̽����Ӧ��������������D��Ũ�����ϣ������ȣ��ޱ仯��������Cl2���ɣ�����Ӧֹͣ������ʣ�࣬��ʱ�μ����ᣬ�ֲ���Cl2���ɴ��ж�Ӱ��÷�Ӧ��Ч���е������У�����ţ�___________��
a���¶� b��Cl-��Ũ�� c����Һ�����
��3��0.1 mol Cl2�뽹̿��TiO2��ȫ��Ӧ������һ�ֻ�ԭ�������һ����ˮ���TiO2��xH2O��Һ̬���������4.28 kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ__________��
��������Ԫ����Һ�ķ��������
��4���ö��Ե缫���ʱ��![]() �ܴӽ�Һ�з��������ԭ����__________�������Ԫ�ص�������_________�����������ɵ�����Ϊ___________��д��ѧʽ����
�ܴӽ�Һ�з��������ԭ����__________�������Ԫ�ص�������_________�����������ɵ�����Ϊ___________��д��ѧʽ����
���𰸡���14�֣�
��1��![]() ���ȣ������գ� ��ⷨ
���ȣ������գ� ��ⷨ
��2��a c
��3��2Cl2(g)+ TiO2(s)+2C(s)===TiCl4(l)+2CO(g) ��H=85.6kJ��mol1
��4����ֱ���糡�����£�CrO42-ͨ�������ӽ���Ĥ���������ƶ������뽬Һ
CrO42-��Cr2O72- NaOH��H2
�����������Ե缫������ャҺʱ��Na+����������CrO42-����������Al(OH)3��MnO2�ڹ��������С������������NaOHʱ��Al(OH)3ת��ΪAlO2-��ͨ��CO2ת��ΪAl(OH)3�������ټ��ȷֽ�ΪAl2O3��������ڵ���Al��
��1��NaOH�ĵ���ʽΪ![]() ����������������B��C������Ϊ���Ȼ����գ�C��Al���Ʊ�������Ϊ��ⷨ��
����������������B��C������Ϊ���Ȼ����գ�C��Al���Ʊ�������Ϊ��ⷨ��
��2������ʵ�鷽����֪��Ӱ��÷�Ӧ���������¶Ⱥ���Һ����ȣ���ѡac��
��3���÷�Ӧ���Ȼ�ѧ����ʽΪ2Cl2(g)+ TiO2(s)+2C(s)===TiCl4(l)+2CO(g) ��H=85.6kJ��mol1��
��4���ö��Ե缫���ʱ��CrO42-�ܴӽ�Һ�з��������ԭ������ֱ���糡�����£�CrO42-ͨ�������ӽ���Ĥ���������ƶ������뽬Һ�������Ԫ�ص�������CrO42-��Cr2O72-�����������ɵ�����ΪNaOH��H2��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������H2��ԭWO3�Ʊ�����W��װ����ͼ��ʾ��Zn������������������ʣ�����ûʳ������Һ������������������������˵����ȷ����
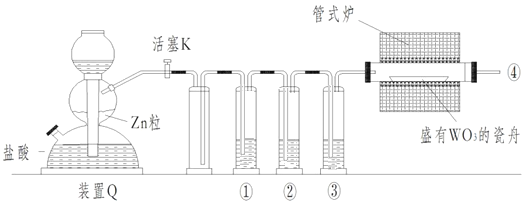
A������������������ʢװKMnO4��Һ��ŨH2SO4������ûʳ������Һ
B����ʽ¯����ǰ�����Թ��������ռ����岢��ȼ��ͨ�������ж����崿��
C��������Ӧʱ���ȹرջ���K����ֹͣ����
D��װ��Q�����շ�������Ҳ�����ڶ���������Ũ���ᷴӦ�Ʊ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[2017����]�¶�ΪT1ʱ���������ݻ���Ϊ1 L�ĺ����ܱ������н�������Ӧ��2NO2(g) ![]() 2NO(g)+O2 (g) (����Ӧ����)��ʵ���ã�v��= v(NO2)����=k��c2(NO2)��v��=v(NO)����=2v(O2)����=k��c2(NO)��c(O2)��k����k��Ϊ���ʳ��������¶�Ӱ�졣����˵����ȷ����
2NO(g)+O2 (g) (����Ӧ����)��ʵ���ã�v��= v(NO2)����=k��c2(NO2)��v��=v(NO)����=2v(O2)����=k��c2(NO)��c(O2)��k����k��Ϊ���ʳ��������¶�Ӱ�졣����˵����ȷ����

A����ƽ��ʱ�����������������е���ѹǿ֮��Ϊ4��5
B����ƽ��ʱ����������![]() ���������еĴ�
���������еĴ�
C����ƽ��ʱ����������NO���������С��50%
D�����¶ȸı�ΪT2ʱ����k��=k������ T2> T1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ǵ�ͳ�в�ҩ���˵���Ч�ɷ�֮һ��������ϸ����ɱ���ж������á������йغ������ص�������ȷ����

A���������صķ���ʽΪC16H13O5
B����������FeCl3��Һ��ɫ
C��1 mol����������ˮ��Ӧ���������1 mol Br2
D��������H2�����ӳɷ�Ӧ�÷����й����ŵ��������1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��������ʵ�Ӧ����ȷ���� ( )
A. �Ȼ�����Һ�����ԣ������������������Ȼ�����Һ
B. ̼������Һ�Լ��ԣ������ȵĴ�����Һ��ȥ����������������
C. ������ѧ����ͨ�������ã��ɽ����ȵ�þ�ۿɷ��ڵ�������ȴ
D. ͭ�Ľ����Ա��������ɽ����ֽ�ˮ��������ͭ���Լ������帯ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ǻ�ѧ�о��г��õķ��������з�����У���ȷ����( )
A. SO2��SiO2��CO������������
B. ϡ���������ᡢ�Ȼ�����Һ��Ϊ����
C. �������֡�ˮ��������ˮ��Ϊ�����
D. �ռ�����ᡢ���Ȼ�̼��Ϊ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����( )
A. �ɱ������ᶼ�ǵ����
B. Na2O2��Fe2O3��CaO�����ڼ�����������������ӻ�����
C. �����Ƿ���ж����ЧӦ���ɽ���ɢϵ��Ϊ��Һ����Һ�ͽ���
D. �е��ʲμӻ��е������ɵķ�Ӧ��һ������������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ڵ���Ⱦ���������ܹ�ע��
��1����Ч��������Ϊ����������β����������ͬʱʵ������β���е�CO��CxHy��NOx���ֳɷֵľ������������������ת���Ĺ�ϵ��ͼ1��ʾ��������X�ɽ�������Ҷ�������ͼ(��ͼ2��ʾ)ȷ����

����ͼʾ��ת���У�����ԭ��Ԫ���� ��X�Ļ�ѧʽΪ ��
����Ԫ�������ڱ��е�λ���� ��
��2��SCR������ʹNOx��NH3ֱ�ӷ�Ӧ��ʵ����ת������NO��NO2�����ʵ���֮��Ϊ2��1ʱ��д��������Ӧ�Ļ�ѧ����ʽ�� ����֪NOx��NH3�ķ�Ӧ��H��0��Ϊ��ߵ��������ת���ʿɲ�ȡ�Ĵ�ʩ�� (��дһ��)��
��3������ClO2 �����������ﷴӦ�������£�NO![]() NO2
NO2![]() N2����Ӧ���Ļ�ѧ����ʽ��2NO + ClO2 + H2O
N2����Ӧ���Ļ�ѧ����ʽ��2NO + ClO2 + H2O![]() NO2 + HNO3 + HCl����Ӧ�������ӷ���ʽ�� ��
NO2 + HNO3 + HCl����Ӧ�������ӷ���ʽ�� ��
��4����������������ƿ�ʹ��ˮ��![]() ��ȫת��ΪN2������������ԭΪNaCl��
��ȫת��ΪN2������������ԭΪNaCl��
��д���������Ƶĵ���ʽ_____________________��
�������ˮ���Ƿ����![]() �ķ����� ��
�ķ����� ��
����������ˮ������0.448 L N2(��״��)����������Ũ��Ϊ2 mol��L1�Ĵ������Ƶ����Ϊ mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪0.3 mol��L��1�ƾ���Һ���ܶ�Ϊ��1 g��mL��1��0.1 mol��L��1�ƾ���Һ���ܶ�Ϊ��2 g��mL��1��������1<��2��������������Һ��������ϣ����þƾ���Һ�����ʵ���Ũ����(����)
A. ����0.2 mol��L��1 B. ����0.2 mol��L��1
C. ��0.2 mol��L��1 D. ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com