
【题目】下列有关物质性质的应用正确的是 ( )
A. 氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液
B. 碳酸钠溶液显碱性,可用热的纯碱溶液除去金属器件表面油污
C. 氮气化学性质通常不活泼,可将炽热的镁粉可放在氮气中冷却
D. 铜的金属性比铁弱,可将海轮浸水部分镶上铜锭以减缓船体腐蚀
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 硫酸钙悬浊液中加入碳酸钠:CaSO4(s) + CO32-(aq)=CaCO3(s) + SO42-(aq)
B. 醋酸铵溶于水:CH3COONH4+ H2O![]() CH3COOH + NH3·H2O
CH3COOH + NH3·H2O
C. 硫酸氢钠溶液中滴入氢氧化钡溶液呈中性:HSO4-+ OH-=SO42-+ H2O
D. 碳酸氢钠水解:HCO3-+ H2O![]() H3O++ CO32-
H3O++ CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅的说法不正确的是( )
A. 硅是人类将太阳能转换为电能的常用材料
B. 硅的导电性介于金属和绝缘体之间,是良好的半导体材料
C. 硅的化学性质不活泼,常温下不与任何物质反应
D. 加热到一定程度时,硅能与氯气、氧气等非金属反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸二乙酯(D)可由石油气裂解得到的烯烃合成。回答下列问题:
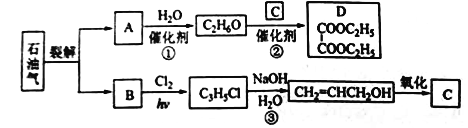
(1)B和A为同系物,B的结构简式为_______。
(2)反应①的化学方程式为___________,其反应类型为__________。
(3)反应③的反应类型为____________。
(4)C的结构简式为___________。
(5)反应②的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A.增加c(CO),平衡向正向移动,反应的平衡常数增大
B.第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
C.第二阶段,Ni(CO)4分解率较低
D.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4,。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。
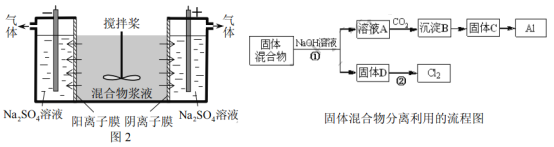
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________。B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化,加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,![]() 能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,6.4g氧气和臭氧混合气体中含有的原子总数为0.4NA
B. 常温常压下,22.4LCl2中含有的分子数为NA
C. 1L1mol·L-1K2SO4溶液中含有的钾离子数为NA
D. 1mol钠与足量水反应电子转移数为11NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于元素周期表的说法正确的是
A. 元素周期表有8个主族 B. ⅠA族的元素全部是金属元素
C. 元素周期表有7个周期 D. 短周期是指第一、二周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(13分)
TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:
![]()
资料:TiCl4及所含杂质氯化物的性质
化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
熔点/℃ | 69 | 25 | 193 | 304 | 714 |
在TiCl4中的溶解性 | 互溶 | —— | 微溶 | 难溶 | |
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
① 沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:_______________________。
② 氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:_______________。
③ 氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________。
④ 氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_____________。
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:
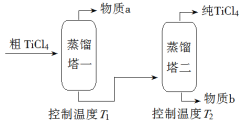
物质a是______________,T2应控制在_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com