
【题目】乙二酸二乙酯(D)可由石油气裂解得到的烯烃合成。回答下列问题:
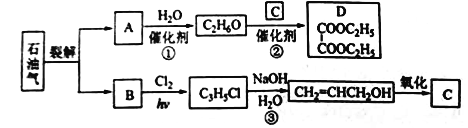
(1)B和A为同系物,B的结构简式为_______。
(2)反应①的化学方程式为___________,其反应类型为__________。
(3)反应③的反应类型为____________。
(4)C的结构简式为___________。
(5)反应②的化学方程式为______。
【答案】 CH2=CHCH3 CH2=CH2+H2O![]() CH3CH2OH 加成反应 取代反应 HOOC-COOH 2CH3CH2OH+HOOCCOOH
CH3CH2OH 加成反应 取代反应 HOOC-COOH 2CH3CH2OH+HOOCCOOH![]() CH3CH2OOCCOOCH2CH3+2H2O
CH3CH2OOCCOOCH2CH3+2H2O
【解析】试题分析:根据流程图可知,A与水反应生成分子式为C2H6O的化合物;C2H6O氢原子数已经达到饱和,属于饱和一元醇,C2H6O为乙醇,A为乙烯,乙醇与C反应生成乙二酸二乙酯,则C为乙二酸,B和A为同系物,B含3个碳,则B为丙烯, 丙烯与氯气光照生成C3H5Cl,C3H5Cl在氢氧化钠水溶液中水解为CH2=CHCH2OH,则C3H5Cl的结构简式是CH2=CHCH2Cl。
解析:根据以上分析,(1)B是丙烯,结构简式为CH2=CHCH3。
(2)乙烯与水发生加成反应生成乙醇的化学方程式为CH2=CH2+H2O![]() CH3CH2OH。
CH3CH2OH。
(3)CH2=CHCH2Cl→CH2=CHCH2OH,氯原子被羟基代替,所以反应③的反应类型为取代反应。
(4)C为乙二酸,C的结构简式为HOOC-COOH。
(5)乙醇与乙二酸发生酯化反应生成乙二酸二乙酯的化学方程式为2CH3CH2OH+HOOCCOOH![]() CH3CH2OOCCOOCH2CH3+2H2O
CH3CH2OOCCOOCH2CH3+2H2O


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】某未知溶液中已检验出含有离子Ca2+、NO3-,且pH=2。欲检验此溶液中是否大量存在以下6种离子:①ClO- ②NH4+ ③I- ④Fe2+ ⑤AlO2- ⑥Cl-,其中不必检验就能排除的离子是
A.②③⑤⑥ B.①③④⑤
C.①④⑤⑥ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
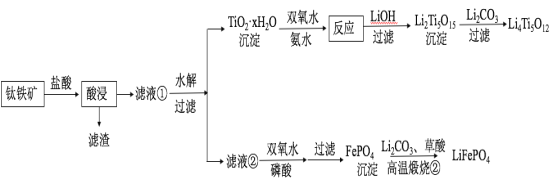
回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。

(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40 ℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017江苏]温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应:2NO2(g) ![]() 2NO(g)+O2 (g) (正反应吸热)。实验测得:v正= v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是
2NO(g)+O2 (g) (正反应吸热)。实验测得:v正= v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是

A.达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为4∶5
B.达平衡时,容器Ⅱ中![]() 比容器Ⅰ中的大
比容器Ⅰ中的大
C.达平衡时,容器Ⅲ中NO的体积分数小于50%
D.当温度改变为T2时,若k正=k逆,则 T2> T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备。完成下列填空:

(1)实验时,通常加入过量的乙醇,原因是__________。加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是_______;浓硫酸用量又不能过多,原因是_______。
(2)饱和Na2CO3溶液的作用是_______________。
(3)反应结束后,将试管中收集到的产品倒入分液漏斗中,______、_______,然后分液。
(4)若用b装置制备乙酸乙酯,其缺点有__________、__________。由b装置制得的乙酸乙酯产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是________,分离乙酸乙酯与该杂质的方法是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是

A.汉黄芩素的分子式为C16H13O5
B.该物质遇FeCl3溶液显色
C.1 mol该物质与溴水反应,最多消耗1 mol Br2
D.与足量H2发生加成反应后,该分子中官能团的种类减少1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的应用正确的是 ( )
A. 氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液
B. 碳酸钠溶液显碱性,可用热的纯碱溶液除去金属器件表面油污
C. 氮气化学性质通常不活泼,可将炽热的镁粉可放在氮气中冷却
D. 铜的金属性比铁弱,可将海轮浸水部分镶上铜锭以减缓船体腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 干冰、盐酸都是电解质
B. Na2O2、Fe2O3、CaO既属于碱性氧化物,又属于离子化合物
C. 根据是否具有丁达尔效应,可将分散系分为溶液、浊液和胶体
D. 有单质参加或有单质生成的反应不一定属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据SO2通入不同溶液中实验现象,所得结论不正确的是
实验 | 现象 | 结论 | |
A | 含HCl、BaCl2的 | 产生白色沉淀 | SO2有还原性 |
B | H2S溶液 | 产生黄色沉淀 | SO2有氧化性 |
C | 酸性KMnO4溶液 | 紫色溶液褪色 | SO2有漂白性 |
D | Na2SiO3溶液 | 产生胶状沉淀 | 酸性:H2SO3>H2SiO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com