
【题目】常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A.增加c(CO),平衡向正向移动,反应的平衡常数增大
B.第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
C.第二阶段,Ni(CO)4分解率较低
D.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】
钛镍形状记忆合金(TiNi)被广泛用于人造卫星和宇宙飞船的天线,在临床医疗领域内也具有广泛的应用。回答下列问题:
(1)写出基态Ti原子的电子排布式:_________,Ni在元素周期表中的位置是_________。
(2)钛镍合金能溶于热的硫酸生成Ti(SO4)2、NiSO4,二者阴离子的立体构型为______,中心原子的轨道杂化类型是_______。
(3)工业上将金红石(主要成分TiO2)转化为液态TiCl4,再用金属镁在高温下还原得到金属钛,同时生成MgCl2。
①MgCl2的熔沸点比TiCl4高得多,其原因是______。
②原子半径r(Cl)_____r(Mg),离子半径r(O2-)______r(Mg2+)(填“>”、“<”或“=”)。
(4)金属镍能与CO反应生成一种配合物Ni(CO)4(常温下为无色液体)。Ni(CO)4的固体属于_____晶体,Ni与CO之间的化学键称为__________,提供孤对电子的成键原子是_________。(填元素符号)
(5)一种钛镍合金的立方晶胞结构如图所示:
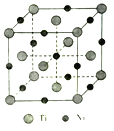
①该合金中Ti的配位数为________。
②若合金的密度为d g/cm3,晶胞边长a=________pm。(用含d的计算式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)
水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
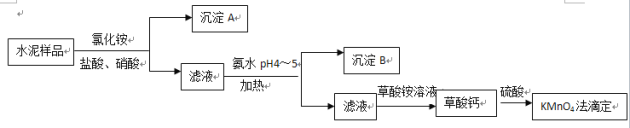
回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是__________,还可使用___________代替硝酸。
(2)沉淀A的主要成分是_________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____________________________________。
(3)加氨水过程中加热的目的是___________。沉淀B的主要成分为_____________、____________(填化学式)。
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:![]() +H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________。
+H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备。完成下列填空:

(1)实验时,通常加入过量的乙醇,原因是__________。加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是_______;浓硫酸用量又不能过多,原因是_______。
(2)饱和Na2CO3溶液的作用是_______________。
(3)反应结束后,将试管中收集到的产品倒入分液漏斗中,______、_______,然后分液。
(4)若用b装置制备乙酸乙酯,其缺点有__________、__________。由b装置制得的乙酸乙酯产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是________,分离乙酸乙酯与该杂质的方法是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的应用正确的是 ( )
A. 氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液
B. 碳酸钠溶液显碱性,可用热的纯碱溶液除去金属器件表面油污
C. 氮气化学性质通常不活泼,可将炽热的镁粉可放在氮气中冷却
D. 铜的金属性比铁弱,可将海轮浸水部分镶上铜锭以减缓船体腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是一种重要的化工原料,工业上用粗MnO2(含有较多的MnO和MnCO3)样品转化为较纯净MnO2的流程如图所示:
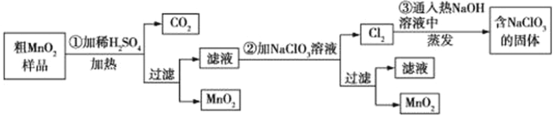
(1)第①步反应中的硫酸能否用浓盐酸代替? (填“能”或“否”),理由是 。
(2)第②步操作中,氧化性强弱顺序:![]() MnO2(填“>”或“<”),写出操作②中发生反应的离子方程式: ;当反应中转移2 mol电子时,生成的氧化产物的物质的量为 mol。
MnO2(填“>”或“<”),写出操作②中发生反应的离子方程式: ;当反应中转移2 mol电子时,生成的氧化产物的物质的量为 mol。
(3)工业上用MnO2为原料制取KMnO4,第一步将MnO2和KOH粉碎,混匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4挡板浓溶液用惰性电极进行电解,在阳极上得到KMnO4,在阴极上得到KOH。
①制取K2MnO4的化学反应方程式为 ,工业上不断搅拌的目的是 。
②电解K2MnO4的浓溶液时,电解的总反应方程式为 。
(4)二氧化锰含量可用碘量法测定,其原理为在盐酸介质中,二氧化锰能定量地将碘离子氧化成碘,以淀粉为指示剂用0.1000 mol/L硫代硫酸钠标准溶液滴定碘而确定二氧化锰含量:
MnO2+4HCl+2KI![]() MnCl2+I2+2KCl+2H2O
MnCl2+I2+2KCl+2H2O
I2+2Na2S2O3![]() 2NaI+Na2S4O6
2NaI+Na2S4O6
取较为纯净的二氧化锰样品a g加入到适量的盐酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗V mL Na2S2O3溶液,则该样品中MnO2含量为 %(杂质不参与反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中能大量共存的是( )
A. 无色溶液中:K+、Na+、MnO4-、SO42-
B. pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
C. 加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
D. 有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将少量饱和FeCl3溶液分别滴加到下列物质中,得到三种分散系,完成相关问题:
甲:饱和FeCl3溶液滴加到冷水中;
乙:饱和FeCl3溶液滴加到NaOH溶液中;
丙:饱和FeCl3溶液滴加到沸水中。
(1)将丙继续加热煮沸到液体呈红褐色,反应的化学方程式为________________________。
(2)如何用最简单的方法判断丙中是否成功制备胶体?_________________________。
(3)向经过检验后的丙中逐渐加入稀盐酸,会出现一系列变化:
①先出现和乙中相同的现象,原因为________________________。
②随后发生变化得到和甲相同的溶液,此反应的离子反应方程式为_____________________。
(4)向丙中加入电极通电后,Fe(OH)3胶体粒子应该移向_______极,说明该胶体粒子带_____电;提纯Fe(OH)3胶体中混有的少量离子可以用的方法是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com