
【题目】MnO2是一种重要的化工原料,工业上用粗MnO2(含有较多的MnO和MnCO3)样品转化为较纯净MnO2的流程如图所示:
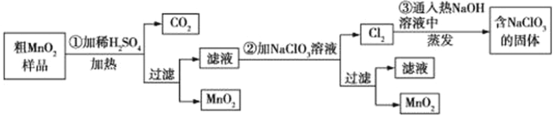
(1)第①步反应中的硫酸能否用浓盐酸代替? (填“能”或“否”),理由是 。
(2)第②步操作中,氧化性强弱顺序:![]() MnO2(填“>”或“<”),写出操作②中发生反应的离子方程式: ;当反应中转移2 mol电子时,生成的氧化产物的物质的量为 mol。
MnO2(填“>”或“<”),写出操作②中发生反应的离子方程式: ;当反应中转移2 mol电子时,生成的氧化产物的物质的量为 mol。
(3)工业上用MnO2为原料制取KMnO4,第一步将MnO2和KOH粉碎,混匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4挡板浓溶液用惰性电极进行电解,在阳极上得到KMnO4,在阴极上得到KOH。
①制取K2MnO4的化学反应方程式为 ,工业上不断搅拌的目的是 。
②电解K2MnO4的浓溶液时,电解的总反应方程式为 。
(4)二氧化锰含量可用碘量法测定,其原理为在盐酸介质中,二氧化锰能定量地将碘离子氧化成碘,以淀粉为指示剂用0.1000 mol/L硫代硫酸钠标准溶液滴定碘而确定二氧化锰含量:
MnO2+4HCl+2KI![]() MnCl2+I2+2KCl+2H2O
MnCl2+I2+2KCl+2H2O
I2+2Na2S2O3![]() 2NaI+Na2S4O6
2NaI+Na2S4O6
取较为纯净的二氧化锰样品a g加入到适量的盐酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗V mL Na2S2O3溶液,则该样品中MnO2含量为 %(杂质不参与反应)。
【答案】(1)否 浓盐酸能被MnO2氧化生成Cl2
(2)> 5Mn2++2![]() +4H2O
+4H2O![]() 5MnO2+Cl2↑+8H+ 1
5MnO2+Cl2↑+8H+ 1
(3)①2MnO2+4KOH+O2![]() 2 K2MnO4+2H2O 使反应物与O2充分接触
2 K2MnO4+2H2O 使反应物与O2充分接触
②2 K2MnO4+2H2O![]() 2KMnO4+2KOH+H2↑
2KMnO4+2KOH+H2↑
(4)![]()
【解析】本题考查考查氧化还原反应的有关知识、滴定方法在物质纯度的测定的应用的知识。(1)第①步反应中的硫酸不能用浓盐酸代替稀硫酸,这是因为MnO2具有氧化性,会将浓盐酸在加热时氧化产生氯气;
(2)在酸性条件下NaClO3可以将Mn2+氧化产生MnO2,其本身被还原产生Cl2,根据物质的氧化性:氧化剂>氧化产物可知“物质的氧化性:![]() >MnO2;根据电子守恒、电荷守恒和原子守恒,可知操作②中发生反应的离子方程式:5Mn2++2
>MnO2;根据电子守恒、电荷守恒和原子守恒,可知操作②中发生反应的离子方程式:5Mn2++2![]() +4H2O
+4H2O![]() 5MnO2 + Cl2↑+8H+;根据方程式可知:每反应产生5 mol氧化产物MnO2,转移电子的物质的量是10 mol,则当反应中转移2 mol电子时,生成的氧化产物的物质的量为1 mol。
5MnO2 + Cl2↑+8H+;根据方程式可知:每反应产生5 mol氧化产物MnO2,转移电子的物质的量是10 mol,则当反应中转移2 mol电子时,生成的氧化产物的物质的量为1 mol。
(3)①MnO2和KOH粉碎,混匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4,则制取K2MnO4的化学反应方程式为2MnO2+4KOH+O2![]() 2 K2MnO4+2H2O;工业上不断搅拌的目的是使反应物与O2充分接触,发生反应,以提高原料的利用率;②将K2MnO4挡板浓溶液用惰性电极进行电解,在阳极上得到KMnO4,在阴极上得到KOH。电解K2MnO4的浓溶液时,电解的总反应方程式为2K2MnO4+2H2O
2 K2MnO4+2H2O;工业上不断搅拌的目的是使反应物与O2充分接触,发生反应,以提高原料的利用率;②将K2MnO4挡板浓溶液用惰性电极进行电解,在阳极上得到KMnO4,在阴极上得到KOH。电解K2MnO4的浓溶液时,电解的总反应方程式为2K2MnO4+2H2O![]() 2KMnO4+2KOH+H2↑;
2KMnO4+2KOH+H2↑;
(4)根据反应方程式MnO2+ 4HCl+2KI![]() MnCl2+I2+2KCl+2H2O ,I2+2Na2S2O3
MnCl2+I2+2KCl+2H2O ,I2+2Na2S2O3![]() 2NaI+Na2S4O6可得关系式:MnO2~I2~2Na2S2O3,n(Na2S2O3)= 0.1000 mol/L×V×103L=V×104 mol;则n(MnO2)=5V×105 mol,m(MnO2)=4.35V×103 g,则该样品中MnO2含量为(4.35V×103 g÷a g)×100%=
2NaI+Na2S4O6可得关系式:MnO2~I2~2Na2S2O3,n(Na2S2O3)= 0.1000 mol/L×V×103L=V×104 mol;则n(MnO2)=5V×105 mol,m(MnO2)=4.35V×103 g,则该样品中MnO2含量为(4.35V×103 g÷a g)×100%=![]() 。
。


科目:高中化学 来源: 题型:
【题目】2014年4月11日10时30分在四川省阿坝州理县发生了4.8级地震。食盐、蔗糖、醋酸、纯碱、 “84消毒液”等是震后居民经常使用的物质,下列有关说法中不正确的是
A. 食盐的主要成分NaCl是电解质
B. 蔗糖是非电解质
C. 固体纯碱能导电
D. “84消毒液”中有效成分NaClO是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是
A. 标准状况下,22.4 L H2O含有的分子数为NA
B. 常温常压下,1.06 g Na2CO3溶于水含有的Na+离子数为0.02 NA
C. 通常状况下,NA个CO2分子占有的体积为22.4 L
D. 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A.增加c(CO),平衡向正向移动,反应的平衡常数增大
B.第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
C.第二阶段,Ni(CO)4分解率较低
D.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸铜和碱式碳酸铜均可溶于盐酸转化为氯化铜。高温下这两种化合物均能分解成氧化铜。溶解28.4g上述混合物,消耗1mol/L盐酸500mL.灼烧等质量的上述混合物,得到氧化铜的质量是
A. 35g B. 30g C. 20g D. 15g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,6.4g氧气和臭氧混合气体中含有的原子总数为0.4NA
B. 常温常压下,22.4LCl2中含有的分子数为NA
C. 1L1mol·L-1K2SO4溶液中含有的钾离子数为NA
D. 1mol钠与足量水反应电子转移数为11NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各元素性质的递变规律错误的是( )
A.Li、Be、B原子最外层电子数依次增多
B.P、S、Cl元素的最高正化合价依次升高
C.B、C、N、O、F原子半径依次增大
D.Li、Na、K、Rb的金属性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的变化过程中,共价键明显被破坏的是
A. 从NH4HCO3中闻到了刺激性气味 B. NaCl颗粒被粉碎
C. I2升华 D. NaOH溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯(代号M)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。用质谱法测得其相对分子质量为162,分子中C、H、O原子个数比为
5︰5︰1,且分子中只含有1个苯环,苯环上只有一个取代基。现测出M的核磁共振氢谱谱图有6个峰,其面积之比为1︰2︰2︰1︰1︰3。利用红外光谱仪可初步检测有机化合物中的某些基团,现测得M分子的红外光谱如下图:

根据以上信息确定肉桂酸甲酯的分子式为___,结构简式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com