
【题目】肉桂酸甲酯(代号M)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。用质谱法测得其相对分子质量为162,分子中C、H、O原子个数比为
5︰5︰1,且分子中只含有1个苯环,苯环上只有一个取代基。现测出M的核磁共振氢谱谱图有6个峰,其面积之比为1︰2︰2︰1︰1︰3。利用红外光谱仪可初步检测有机化合物中的某些基团,现测得M分子的红外光谱如下图:

根据以上信息确定肉桂酸甲酯的分子式为___,结构简式为___。
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】MnO2是一种重要的化工原料,工业上用粗MnO2(含有较多的MnO和MnCO3)样品转化为较纯净MnO2的流程如图所示:
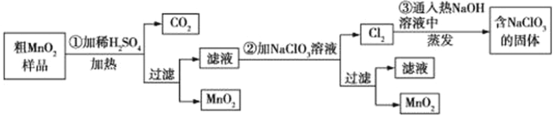
(1)第①步反应中的硫酸能否用浓盐酸代替? (填“能”或“否”),理由是 。
(2)第②步操作中,氧化性强弱顺序:![]() MnO2(填“>”或“<”),写出操作②中发生反应的离子方程式: ;当反应中转移2 mol电子时,生成的氧化产物的物质的量为 mol。
MnO2(填“>”或“<”),写出操作②中发生反应的离子方程式: ;当反应中转移2 mol电子时,生成的氧化产物的物质的量为 mol。
(3)工业上用MnO2为原料制取KMnO4,第一步将MnO2和KOH粉碎,混匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4挡板浓溶液用惰性电极进行电解,在阳极上得到KMnO4,在阴极上得到KOH。
①制取K2MnO4的化学反应方程式为 ,工业上不断搅拌的目的是 。
②电解K2MnO4的浓溶液时,电解的总反应方程式为 。
(4)二氧化锰含量可用碘量法测定,其原理为在盐酸介质中,二氧化锰能定量地将碘离子氧化成碘,以淀粉为指示剂用0.1000 mol/L硫代硫酸钠标准溶液滴定碘而确定二氧化锰含量:
MnO2+4HCl+2KI![]() MnCl2+I2+2KCl+2H2O
MnCl2+I2+2KCl+2H2O
I2+2Na2S2O3![]() 2NaI+Na2S4O6
2NaI+Na2S4O6
取较为纯净的二氧化锰样品a g加入到适量的盐酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗V mL Na2S2O3溶液,则该样品中MnO2含量为 %(杂质不参与反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑火药是我国四大发明之一,黑火药爆炸反应为:2KNO3+S+3C=K2S+N2↑+3CO2↑其中作为氧化剂的是
A. KNO3 B. C C. KNO3和S D. KNO3 和C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将少量饱和FeCl3溶液分别滴加到下列物质中,得到三种分散系,完成相关问题:
甲:饱和FeCl3溶液滴加到冷水中;
乙:饱和FeCl3溶液滴加到NaOH溶液中;
丙:饱和FeCl3溶液滴加到沸水中。
(1)将丙继续加热煮沸到液体呈红褐色,反应的化学方程式为________________________。
(2)如何用最简单的方法判断丙中是否成功制备胶体?_________________________。
(3)向经过检验后的丙中逐渐加入稀盐酸,会出现一系列变化:
①先出现和乙中相同的现象,原因为________________________。
②随后发生变化得到和甲相同的溶液,此反应的离子反应方程式为_____________________。
(4)向丙中加入电极通电后,Fe(OH)3胶体粒子应该移向_______极,说明该胶体粒子带_____电;提纯Fe(OH)3胶体中混有的少量离子可以用的方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2016上海]NaCN超标的电镀废水可用两段氧化法处理:
(1)NaCN与NaClO反应,生成NaOCN和NaCl
(2)NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×1010)有剧毒;HCN、HOCN中N元素的化合价相同。
完成下列填空:
(1)第一次氧化时,溶液的pH应调节为____________________(选填“酸性”、“碱性”或“中性”);原因是______________________________。
(2)写出第二次氧化时发生反应的离子方程式:_______________________________________
(3)处理100 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO___________g(实际用量应为理论值的4倍,才能使NaCN含量低于0.5 mg/L,达到排放标准)。
(4)(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成_________、__________和H2O。
(5)上述反应涉及到的元素中,氯原子核外电子能量最高的电子亚层是___________;H、C、N、O、Na的原子半径从小到大的顺序为_______。
(6)HCN是直线型分子,HCN是___________分子(选填“极性”、“非极性”)。HClO的电子式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算
(1)2.33gBaSO4的物质的量________mol。
(2)标准状况下6.72L N2的物质的量________mol。
(3)等质量的O2与O3在同温同压下的体积之比_______。
(4)同温同压同体积的CO2与SO2的质量之比________。
(5)同温同压下条件下CO与CO2的密度之比_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 钠、氢气都能在氯气中燃烧生成白色烟雾
B. 铜丝在氯气中燃烧,生成蓝绿色的氯化铜
C. 检验Cl2气体中是否混有HCl的方法是将气体通入硝酸银溶液
D. 将CO2通入次氯酸钙溶液可生成具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有c(CH3COOH)+c(CH3COO-)=0.1molL-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是( )

A. pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B. 该温度下醋酸的电离平衡常数为10-4.75
C. pH=3.5的溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1molL-1
D. 向W点所表示的溶液中加入等体积的0.05molL﹣1NaOH溶液:c(H+)=c(CH3COOH)+c(OH﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com