
【题目】将少量饱和FeCl3溶液分别滴加到下列物质中,得到三种分散系,完成相关问题:
甲:饱和FeCl3溶液滴加到冷水中;
乙:饱和FeCl3溶液滴加到NaOH溶液中;
丙:饱和FeCl3溶液滴加到沸水中。
(1)将丙继续加热煮沸到液体呈红褐色,反应的化学方程式为________________________。
(2)如何用最简单的方法判断丙中是否成功制备胶体?_________________________。
(3)向经过检验后的丙中逐渐加入稀盐酸,会出现一系列变化:
①先出现和乙中相同的现象,原因为________________________。
②随后发生变化得到和甲相同的溶液,此反应的离子反应方程式为_____________________。
(4)向丙中加入电极通电后,Fe(OH)3胶体粒子应该移向_______极,说明该胶体粒子带_____电;提纯Fe(OH)3胶体中混有的少量离子可以用的方法是_______。
【答案】 FeCl3 + 3H2O![]() Fe(OH)3(胶体) + 3HCl 用强光照射,若有光亮的“通路”则已经制备成功(答“丁达尔效应”也给分) Fe(OH)3胶体发生了聚成,形成沉淀 Fe(OH)3 + 3H+ = Fe3++3H2O 阴 正 渗析
Fe(OH)3(胶体) + 3HCl 用强光照射,若有光亮的“通路”则已经制备成功(答“丁达尔效应”也给分) Fe(OH)3胶体发生了聚成,形成沉淀 Fe(OH)3 + 3H+ = Fe3++3H2O 阴 正 渗析
【解析】(1)将丙继续加热煮沸到液体呈红褐色生成氢氧化铁胶体,反应的化学方程式为FeCl3 + 3H2O![]() Fe(OH)3(胶体) + 3HCl。(2)胶体具有丁达尔效应,因此判断丙中是否成功制备胶体的操作是用强光照射,若有光亮的“通路”则已经制备成功。(3)①由于Fe(OH)3胶体遇到电解质会发生聚成,因而形成红褐色沉淀。②氢氧化铁能与盐酸发生反应生成氯化铁和水,此反应的离子反应方程式为Fe(OH)3 +3H+ =Fe3++3H2O。(4)氢氧化铁胶体的胶粒带正电荷,因此向丙中加入电极通电后,Fe(OH)3胶体粒子应该移向阴极;胶体不能透过半透膜,所以提纯Fe(OH)3胶体中混有的少量离子可以用的方法是渗析。
Fe(OH)3(胶体) + 3HCl。(2)胶体具有丁达尔效应,因此判断丙中是否成功制备胶体的操作是用强光照射,若有光亮的“通路”则已经制备成功。(3)①由于Fe(OH)3胶体遇到电解质会发生聚成,因而形成红褐色沉淀。②氢氧化铁能与盐酸发生反应生成氯化铁和水,此反应的离子反应方程式为Fe(OH)3 +3H+ =Fe3++3H2O。(4)氢氧化铁胶体的胶粒带正电荷,因此向丙中加入电极通电后,Fe(OH)3胶体粒子应该移向阴极;胶体不能透过半透膜,所以提纯Fe(OH)3胶体中混有的少量离子可以用的方法是渗析。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A.增加c(CO),平衡向正向移动,反应的平衡常数增大
B.第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
C.第二阶段,Ni(CO)4分解率较低
D.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的变化过程中,共价键明显被破坏的是
A. 从NH4HCO3中闻到了刺激性气味 B. NaCl颗粒被粉碎
C. I2升华 D. NaOH溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,向500—600℃的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行试验。

回答下列问题:
(1)制取无水氯化铁的实验中,A中反应的化学方程式为 ,装置B中加入的试剂是 。
(2)制取无水氯化亚铁的实验中,装置A用来制取___________。尾气的成分是 。若仍用D的装置进行尾气处理,存在的问题是 、 。
(3)若操作不当,制得的FeCl2会含有少量FeCl3,检验FeCl3常用的试剂是___________。欲制得纯净的FeCl2,在实验操作中应先 ,再 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是( )
A.蒸馏B.萃取C.干馏D.升华
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(13分)
TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:
![]()
资料:TiCl4及所含杂质氯化物的性质
化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
熔点/℃ | 69 | 25 | 193 | 304 | 714 |
在TiCl4中的溶解性 | 互溶 | —— | 微溶 | 难溶 | |
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
① 沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:_______________________。
② 氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:_______________。
③ 氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________。
④ 氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_____________。
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:
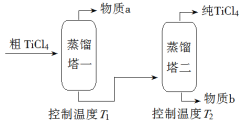
物质a是______________,T2应控制在_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯(代号M)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。用质谱法测得其相对分子质量为162,分子中C、H、O原子个数比为
5︰5︰1,且分子中只含有1个苯环,苯环上只有一个取代基。现测出M的核磁共振氢谱谱图有6个峰,其面积之比为1︰2︰2︰1︰1︰3。利用红外光谱仪可初步检测有机化合物中的某些基团,现测得M分子的红外光谱如下图:

根据以上信息确定肉桂酸甲酯的分子式为___,结构简式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用金属活动性顺序表解释的是
A. 使用铝制水壶烧水
B. 用铁丝而不用铜丝做焰色反应的实验
C. 工业上常用热还原法冶炼铁,用电解法冶炼钠
D. 铝既能与强酸溶液反应,也能与强碱溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com